Как узнать двойная или тройная связь. Что значит "ковалентная связь"
ковалентная связь
вид химической связи; осуществляется парой электронов, общих для двух атомов, образующих связь. Атомы в молекуле могут быть соединены одинарной ковалентной связью (H2, H3C-CH3), двойной (H2C=CH2) или тройной (N2, HCCH). Атомы, различающиеся по электроотрицательности, образуют т.н. полярную ковалентную связь (HCl, H3C-Cl).
Ковалентные связи ковалентных связей: ковалентная связь между атомами образуется, когда атомы разделяют электроны для достижения полной внешней оболочки электронов. могут быть представлены несколькими различными способами. Ниже приведены примеры прямых линий и изображений трехмерных моделей. Заметим, что молекулы могут иметь двойную ковалентную связь, то есть у них есть две общие пары электронов - или тройная ковалентная связь - три общих пары электронов. Двойная ковалентная связь показана двойной линией и тройной связью тройной линией.
один из видов химической связи между двумя атомами, которая осуществляется общей для них электронной парой (по одному электрону от каждого атома). К. с. существует как в молекулах (в любых агрегатных состояниях), так и между атомами, образующими решетку кристалла. К. с. может связывать одинаковые атомы (в молекулах H2, Cl2, в кристаллах алмаза) или разные (в молекулах воды, в кристаллах карборунда SiC). Почти все виды основных связей в молекулах органических соединений являются ковалентными (С ≈ С, С ≈ Н, С ≈ N и др.). К. с. очень прочны. Этим объясняется малая химическая активность парафиновых углеводородов. Многие неорганические соединения, кристаллы которых имеют атомную решётку, то есть образуются с помощью К. с., являются тугоплавкими, обладают высокой твёрдостью и износостойкостью. К ним принадлежат некоторые карбиды, силициды, бориды, нитриды (в частности, известный боразон BN), нашедшие применение в новой технике. См. также Валентность и Химическая связь.
Молекула кислорода состоит из двух атомов кислорода, удерживаемых двойной связью, например. Молекула азота имеет два атома азота, удерживаемых тройной связью, например. Точечные диаграммы являются еще одним способом представления ковалентных связей. Общий электрон от одного атома показан как точка, а общий электрон от другого атома показан как крест.
При рисовании точек и поперечных диаграмм для ковалентных связей вам нужно всего лишь показать электроны на самом высоком занятом энергетическом уровне, поскольку только они задействованы. Анимации показывают ковалентные связи, представленные как прямыми линиями, так и диаграммами точек и кросс.
══В. А. Киреев.
Википедия
Ковалентная связь
Ковалентная связь (от лат. co - «совместно» и vales - «имеющий силу») - химическая связь , образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой .
Ниже - ковалентное связывание между атомами кислорода с образованием молекулы кислорода. Самый низкий уровень энергии не показан. Ковалентные связи - это силы притяжения, образованные, когда атомы молекулы разделяют электроны. Термин, разделяющий электроны, указывает на то, что валентные электроны атомов становятся частью орбиталей более одного атома молекулы. Это показано на следующих диаграммах.
На рисунке ниже показаны два отдельных атома водорода. Каждый атом имеет один валентный электрон и ядро с одним протоном. На рисунке ниже два атома водорода разделяют электроны валентной орбитали отдельных атомов водорода, так что каждый атом водорода теперь разделяет два электрона. На этом рисунке также показаны два других способа отображения молекулы водорода. Эта линия представляет собой одну ковалентную связь, состоящую из двух общих электронов. На следующем рисунке представлены два атома кислорода, которые делят валентные электроны.
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом.
Таким образом, на рисунке изображена молекула кислорода. В молекуле кислорода два атома разделяют четыре электрона. Две линии указывают на двойную ковалентную связь. На следующем рисунке один атом кислорода разделяет электроны с двумя атомами водорода. Каждый атом водорода разделяет два электрона с атомом кислорода, так что между кислородом и водородом образуются отдельные ковалентные связи.
Когда в начале дидактического блока мы сделали в лаборатории классификацию веществ по их свойствам, мы сформировали три группы. Мы изучили группу, которую мы обозначили как «соли», то есть группу веществ с ионной связью. Затем мы изучаем металлы, и теперь мы собираемся изучить группу «другие». Общим свойством этих веществ было то, что они не проводили ток, даже не растворяясь в воде, их низкую или очень низкую температуру плавления. Во всяком случае, это была очень гетерогенная группа, и мы разделили ее на несколько подгрупп.
Позднее (1927 год) Ф. Лондон и В. Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары:
Неполярные ковалентные вещества. Эта связь находится между одними и теми же неметаллическими атомами. Эта связь удерживает молекулы основных газов вместе. Из этих свойств мы должны определить, как связаны между собой их атомы. Это значительно поможет тому, что мы уже изучили об ионных веществах: когда атомы соединены вместе, они стремятся к стабильной электронной структуре благородных газов.
Ионные вещества состоят из атомов металла и неметалла. Атом металла дает несколько электронов, которые он имеет на последнем уровне, к неметаллическому, так как он не имеет возможности завершить октет. Таким образом образуются два иона, и электрическое притяжение между ионами приводит к образованию твердого вещества.
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Льюис предложил следующее объяснение объединения атомов металлов. Единственная возможность состоит в том, что электрон каждого атома, т.е. пара электронов, принадлежит общей орбите, что оба атома имеют пару электронов. Таким образом, каждый атом имеет 8 электронов на последнем уровне, 6, которые ему соответствуют, и 2 акции, применяя электронную структуру благородного газа.
Эта аполярная ковалентная связь называется потому, что молекула электрически компенсируется. Он не имеет электрических полюсов, он неполярный. Трудно образовать твердое тело, так как эти молекулы являются рыхлыми, и поэтому обычно образуется газ. Позже мы увидим, что существуют межмолекулярные силы, которые могут привести к образованию твердых тел, как в случае йода, но в любом случае они будут мало интенсивными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H, Cl, N) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Вы можете попытаться объяснить образование молекул водорода. кислород. метан. озоном. и хлор. Вы можете попытаться объяснить, почему неполярные ковалентные вещества не растворяются в воде и не проводят электрический ток. Два атома, когда они разделяют некоторый электрон последнего уровня, создают ковалентную связь для получения стабильной структуры инертных газов. Если вы разделяете пару электронов, ссылка проста; если они разделяют две пары, это двойное; если они разделяют три, тройные.
Валентность теперь совпадает с числом электронов, разделяемых атомом. Полярные ковалентные вещества. До сих пор мы видели только ковалентную связь между одними и теми же атомами. Эта ссылка отвечает за свойства, входящие в состав веществ, классифицированных в других. В этой широкой группе есть еще одна часть, в которую входят вода, аммиак, хлористый водород, которые обычно являются жидкостями или газами, которые легко разжижаются, хорошо растворяются в воде, обладают некоторой проводимостью и т.д.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Его молекулы образованы атомами неметаллических элементов, но различны. Этими атомами будут те, которые нуждаются в совместном использовании электронов для завершения октета на последнем уровне. Поэтому они будут теми, у которых на этом последнем уровне будет достаточно электронов, т.е. неметаллов.
При образовании молекулы воды кислород разделяет два электрона, по одному с каждым атомом водорода. Таким образом, электроны приобретают конфигурацию благородного газа, они соответствуют правилу октета. Но в молекуле образуется часть с большим отрицательным зарядом, другая с положительным зарядом.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары». Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H .
Молекулярный ион водорода H содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α=0,53 А и является центром симметрии молекулярного иона водорода H.
Эти заряды отвечают за свойства полярных ковалентных веществ. Эти вещества хорошо растворяются в воде. Притяжение между этими электрическими зарядами обеспечивает силы притяжения между молекулами, что делает их жидкими при комнатной температуре, как вода.
Однако мы не должны путать полярную ковалентную связь и ионную связь. В ионной связи металл теряет электроны последнего уровня, а неметалл получает их, соединяя полученные ионы. В ковалентной связи, наоборот, электроны не заработаны или не потеряны, а разделены. Связь не между ионами, а между нейтральными атомами. Структура сети не сформирована.
n1.doc
3.2. Ковалентная связьКовалентная связь - это двухэлектронная, двухцентровая связь, осуществляемая за счет обобществления пары электронов.
Рассмотрим механизм образования ковалентной связи на примере молекулы водорода Н 2 .
Ядро каждого атома водорода окружено сферическим электронным облаком 1s- электрона. При сближении двух атомов ядро первого атома притягивает электрон второго, а электрон первого атома притягивается ядром второго. В результате происходит перекрывание их электронных облаков с образованием общего молекулярного облака. Таким образом, в результате перекрывания электронных облаков атомов образуется ковалентная связь.
Если он мал, образуется полярная ковалентная связь. Указывает тип ссылки для каждого из них. Представляет соединения с использованием диаграмм Льюиса. Классифицируйте их в соответствии с полярностью их ссылок. Ковалентные вещества, которые образуют сети.
Алмаз - странный и красивый случай. Как вы уже знаете, алмаз - драгоценный камень. Вы также узнаете, что алмаз состоит из атомов углерода. У атома углерода на последнем уровне есть 4 электрона. Поэтому для формирования октета необходимо разделить 4 электрона. И так происходит, разделяя упомянутые электроны с другими атомами углерода, образуя ковалентные связи.
Схематически это можно изобразить следующим образом:
Н + Н Н : Н
Аналогично образуется ковалентная связь в молекуле хлора:
. . . . . . . .
: Cl + Cl Cl : Cl :
. . . . . . . .
Если связь образуют одинаковые атомы (с одинаковой электроотрицательностью), то электронное облако располагается симметрично относительно ядер двух атомов. В этом случае говорят о ковалентной неполярной связи .
Но его электронная структура сильно отличается от структуры молекул, которые мы видели до сих пор. В этих молекулах мы видели, что атомы образуют двойные молекулы и что связи между молекулами были слабыми. По этой причине эти вещества имеют очень низкие температуры плавления и кипения, и большинство из них представляют собой газы или твердые частицы, которые легко плавятся.
В алмазе атом углерода не разделяет 4 электрона с другим атомом, но с еще 4 атомами углерода. Каждый из этих атомов объединен с четырьмя другими. Таким образом формируется сеть, объединенная сильными ковалентными связями, гигантская структура, подобная той, что изображена на рисунке.
Ковалентная полярная связь образуется, когда взаимодействуют атомы с различной электроотрицательностью.
. . . .
Н + Cl Н : Cl :
. . . .
Электронное облако связи несимметричное, смещено к одному из атомов с большей электроотрицательностью, в данном случае к хлору.
Приведенные примеры характеризуют ковалентную связь, которая образуется по обменному механизму .
С другой стороны, алмаз не будет проводить электрический ток, поскольку он не имеет электронов или ионов в свободе. Тот факт, что алмаз считается драгоценным камнем, связан с его твердостью, прозрачностью, тем, как он разлагает свет и его дефицит. Большая часть углерода на Земле не имеет алмазной структуры, а графитовой структуры. Помните, что графит также образован атомами углерода, но его внешний вид совсем другой, просто посмотрите на карандашную шахту, с которой вы пишете.
В этом случае атом углерода разделяет электроны с тремя другими атомами, образуя плоскую гексагональную структуру. Четвертый недостающий электрон расположен между двумя слоями. Атомы этой структуры также связаны сильными связями, а температура плавления аналогична температуре алмаза. Однако графит не является трудным, так как слои могут легко скользить друг над другом. Поскольку он имеет свободные электроны, графит является хорошим проводником. Между прочим, это не очень мило.
Второй механизм образования ковалентной связи - донорно-акцеп-торный . В этом случае связь образуется за счет неподеленной электронной пары одного атома (донора) и свободной орбитали другого атома (акцептора):
Н 3 N: + H + +
Соединения с ковалентной связью называются атомными
.
Условия образования химической связи
1. Химическая связь образуется при достаточном сближении атомов в том случае, если полная внутренняя энергия системы понижается. Таким образом, образующаяся молекула оказывается более устойчивой, чем отдельные атомы и обладает меньшей энергией.
2. Возникновение химической связи всегда экзотермический процесс.
3. Обязательным условием образования химической связи является наличие повышенной электронной плотности между ядрами.
Так, например радиус атома водорода составляет 0,053 нм. Если бы атомы водорода только сближались при образовании молекулы, то межъядерное расстояние было бы 0,106 нм. На самом деле это расстояние 0,074 нм, следовательно, сближение ядер приводит к увеличению электронной плотности.
Количественные характеристики химической связи
1. Энергия связи, Е, кДж/моль
Энергия связи - это энергия, которая выделяется при образовании связи или количество энергии, которую нужно затратить на разрыв связи.
Чем больше энергия связи, тем прочнее соединение. Энергия связи большинства ковалентных соединений находится в пределах 200 - 800 кДж/моль.
2. Длина связи, r 0 , нм
Длина связи - это расстояние между центрами атомов (межъядерное расстояние).
Чем меньше длина связи, тем прочнее соединение.
Таблица 3.1.
Значения энергии и длины некоторых связей
| Связь | r 0 , нм | Е, кДж/моль |
| С - С | 0, 154 | 347 |
| С = С | 0,135 | 607 |
| С С | 0,121 | 867 |
| H - F | 0,092 | 536 |
| H - Cl | 0,128 | 432 |
| H - Br | 0,142 | 360 |
| H - I | 0,162 | 299 |
3. Валентные углы
зависят от пространственной структуры.
Свойства ковалентной связи
1. Направленность ковалентной связи
возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов, что обусловливает пространственную структуру молекул, т.е. их форму.
Различают -связи - связи, образованные вдоль линии, связывающей центры атомов. -связи могут образовывать s - s , s - p и p - p электронные облака.
-связь может быть образована только р - р электронными облаками.
-связь - это связь, образованная по обе стороны от линии, связывающей центры атомов. Эта связь характерная только для соединений с кратными связями (двойными и тройными).
Схемы образования - и - связей представлены на рис. 3.1.
Рис. 3.1. Схемы образования - и - связей.
2. Насыщаемость ковалентной связи - полное использование атомом валентных орбиталей.
3.3. Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов (1 е - 16 элементов; 2 е - 58 элементов,
3 е - 4 элемента; по 5 е у Sb и Bi, а 6 е у Ро). Последние три элемента не являются типичными металлами.
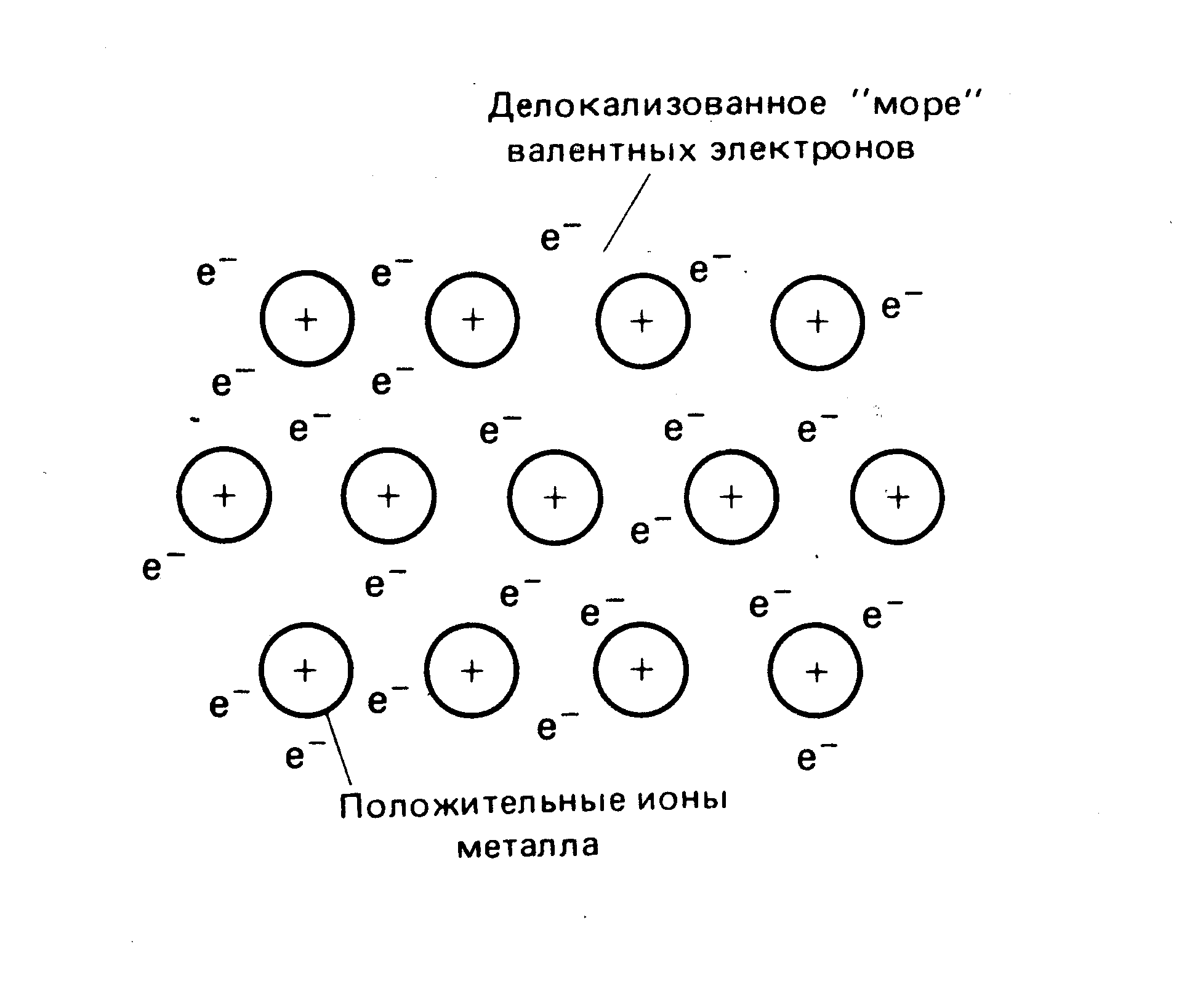
В обычных условиях металлы представляют собой твердые кристаллические вещества (кроме ртути). В узлах металлической кристаллической решетки находятся катионы металлов.

Рис. 3.2. Схема образования металлической связи.
Валентные электроны обладают небольшой энергией ионизации, и поэтому слабо удерживаются в атоме. Электроны перемещаются по всей кристаллической решетке и принадлежат всем его атомам, представляя собой так называемый “электронный газ” или "море валентных электронов". Таким образом, химическая связь в металлах сильно делокализована. Этим определяются такие характерные для металлов свойства как высокие тепло- и электропроводность, ковкость, пластичность.
Металлическая связь характерна для металлов и сплавов в твердом и жидком состоянии. В парообразном состоянии металлы состоят из отдельных молекул (одноатомных и двухатомных), связанных между собой ковалентными связями.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter