Типы химических связей в органических. Водородные связи с свойства органических соединений. Что будем делать с полученным материалом
5. Водородные связи с свойства органических соединений
Водородная связь возникает при взаимодействии кислотных Х–Н и основных В групп, принадлежащих одной или разным молекулам. При объединении одинаковых молекул образуются ассоциаты, объединение разных молекул принято называть молекулярными комплексами (Н-комплексами). Такие взаимодействия составляют самый обширный класс Н-связей, называемых межмолекулярными водородными связями. Межмолекулярные взаимодействия не ограничиваются образованием бинарных комплексов, а могут приводить к структурам со множественными связями (вода, фтористый водород, спирты, фенолы, амиды, полипептиды, белки). Межмолекулярные водородные связи могут приводить к образованию цепей, колец или пространственных сеток. Аналогичные образования сохраняются и в кристаллах.
Кислород и водород образуют воду, и водород выглядит примерно так. У вас там атом водорода. Они сказали, эй, почему мы не собираемся вместе. Позвольте мне переписать этот кислород таким образом, так что становится ясно, что мы разделяем. И эти водороды идут вместе, и они делят один водород, один водород Там этот человек может притворяться, будто у него есть первая оболочка, потому что вы можете поместить туда только два. Это то, где восемь правил ломаются в первой оболочке. И теперь кислород может притворяться, будто у него в его валентной оболочке восемь электронов.
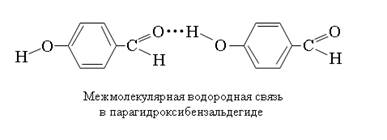
Если Н-связывание наступает в результате взаимодействия кислотного и основного фрагментов внутри одной молекулы, то образующиеся связи называют внутримолекулярными. Соединения с такими связями составляют другую большую группу соединений с водородной связью. Естественно, что образование внутримолекулярных водородных связей возможно, если структура молекулы допускает пространственное сближение фрагментов Х–Н и В до длины водородной связи. Возможность образования внутримолекулярной водородной связи не является препятствием для образования и межмолекулярных водородных связей. В качестве примера рассмотрим изомерные орто- и парагидроксибензальдегиды. Салициловый альдегид (орто-изомер) способен к образованию как внутри-, так и межмолекулярных водородных связей, тогда как для пара-изомера положение взаимодействующих групп допускает образование только межмолекулярных водородных связей
Так что это тоже ковалентная связь. Это эквивалентные утверждения, но в этой ситуации кислород более электроотрицателен, чем водород. Он хочет получить электроны больше, чем водород. электроны будут тратить больше времени на кислород, чем на водород. Это называется полярной ковалентной связью, но это полярно, потому что электроны тянутся, чтобы провести большую часть своего времени на одной стороне атома. И так как это так, молекула в целом, совокупность атомов, будет иметь полярность. Одна сторона молекулы будет более отрицательной, чем другая сторона, которая будет более положительной, потому что электроны проводят больше времени с этой стороны.

Экспериментально довольно легко отличить внутримолекулярную водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется.
Но с металлами вы не можете реально нарисовать там электронную структуру. Но что происходит, скажем, у нас есть железо, верно? И у вас есть только куча нейтральных атомов железа, сидящих вокруг. И мы установили одну общность металлов, что делает что-то металлическое или имеет металлические характеристики, что у них есть куча электронов на их внешней орбите, которые они очень дарят. Поэтому, если вы положите кучу этих ребят вместе, они делят свои электроны.
Они очень общительны. И тогда их электроны просто формируют это море здесь. И поскольку их электроны находятся на берегу моря, и они получили такой положительный заряд, они притягиваются к морю, которое они создали. Они привлекают их общий пул электронов, который все атомы пожертвовали, И это по существу то, что позволяет, безусловно, металлы быть проводящими, потому что у вас есть этот пул электронов, которые очень легко перемещаться. А также это делает их податливыми. Потому что, даже если у вас есть визуально. это немного интуитивно.
Водородные связи влияют на перераспределение электронной плотности в молекулах, что не может не отразиться на свойствах веществ. В случае слабых водородных связей изменение электронной плотности протекает в основном в пределах фрагмента Х–Н…В. С увеличением энергии водородной связи перераспределение электронной плотности затрагивает все атомы молекул, входящих в молекулярный комплекс, что в конечном итоге приводит к глубоким изменениям физических и химических свойств веществ. На свойства органических соединений оказывают значительное влияние как внутри-, так и межмолекулярные водородные связи. Влияние последних, особенно на физические свойства, является более существенным, так как межмолекулярные взаимодействия приводят к увеличению молекулярной массы со всеми вытекающими последствиями.
Но вы можете их переместить. Вы можете себе представить, что это своего рода большой пудинг электронов или большой клей электронов. И вы можете двигаться, вы можете согнуть стержень или сплющить стержень, не разрывая его или не ломким. Хотя, если вы говорите о солях, которые имеют очень сильную, но жесткую связь, если вы попытаетесь согнуть соль соли, связь будет просто нарушена. Там нет, своего рода, мягкий электронный месиво, которое вы можете согнитесь вокруг и играйте. Во всяком случае, так это три облигации.
И, надеюсь, это дает вам немного интуиции. И это супер полезно, потому что в остальной части химии все, что мы делаем, будет по существу связано с некоторой комбинацией этих связей. И мы начнем говорить о том, что означают эти связи в терминах температуры, при которой они кипят, или свойств самих молекул. Во всяком случае, увидимся в следующем видео. Химическое связывание в органических молекулах.
Теперь попытаемся ориентировочно оценить, насколько широко представлены водородные связи в органической химии. Все органические соединения за самым редким исключением содержат водород, то есть являются кислотами Бренстеда, а наиболее часто входящие в их состав элементы-органогены (O, N, S, галогены) содержат неподеленные пары электронов и могут выступать в качестве основных центров. Учитывая отмеченное, можно сказать, что большинство органических соединений потенциально способно к образованию водородных связей. По структурной формуле (природа взаимодействующих групп и их взаимное расположение) можно предсказать силу водородных связей и их характер (внутри- или межмолекулярные). При оценке взаимного влияния атомов в молекулах обязательно учитываются возможность образования водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей. Таким образом, подготовка грамотного химика невозможна без овладения всем комплексом вопросов, связанных с водородной связью.
Электронная структура углов привязки атомов и формы молекул Полярные молекулы и неполярные молекулы Ковалентные связки: гибридные орбитали. Химическое связывание в органических молекулах Электронная структура атомов. Максимальное количество электронов в слое.
Распределение орбиталей в слоях. В подслоях электроны группируются на орбиталях. Правила определения электронной конфигурации атомов. Электронная конфигурация атомов в основном состоянии. Атомы без конфигурации благородного газа обычно реагируют на такую конфигурацию.
Рассмотрим несколько наиболее характерных примеров влияния водородных связей на свойства органических соединений. Прежде всего это так называемые прототропные процессы – превращения, связанные с переносом протона. Известно, что енольные структуры (гидроксильная группа находится при углероде с кратной связью =С–ОН) являются неустойчивыми и в органической химии часто такие формулы берут в квадратные скобки как указание на их нереальность, гипотетичность. В то же время β-дикетоны и другие 1,3-дикарбонильные соединения способны существовать в двух формах: кетонной и енольной. Для ацетоуксусного эфира эти превращения могут быть представлены схемой
Это может происходить посредством ионной связи или ковалентной связи. Он не имеет предпочтительной ориентации в пространстве. Некоторые характеристики ионных веществ: - Обычно высокие температуры плавления. В полярных растворителях, здоровых растворителях и таких растворах проводят электрический ток.
Пример реакции, в которой происходит образование ионной связи. Ионные соединения: ионная составная структура. Равные или подобные электроотрицательные атомы. Связь, которая возникает, когда атомы разделяют электроны. Они достигают конфигурации благородного газа, разделяя электроны.
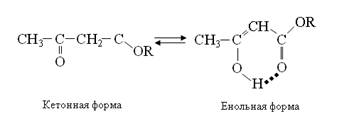
Образование энергетически менее выгодной енольной формы объясняется как формированием системы сопряженных связей С=С–С=О, что всегда является стабилизирующим фактором, так и тем обстоятельством, что между енольным гидроксилом и карбонильным кислородом образуется внутримолекулярная водородная связь, понижающая свободную энергию енольной формы как путем “закрепления” атома водорода у более электроотрицательного элемента, так и в результате удлинения цепи сопряжения (Н-связь включена в круговую цепь сопряжения). С учетом водородных связей не только объясняют реальность енольной структуры, но и количество этой формы в таутомерной системе. На состояние кето-енольного равновесия большое влияние оказывает природа растворителя. Максимальное количество енольной формы отмечается в нейтральных неполярных растворителях (углеводороды). В водных растворах количество енольной формы незначительно, так как вода конкурентно образует с карбонильным кислородом межмолекулярные водородные связи, разрушая стабилизирующие енольную форму внутримолекулярные водородные связи.
Длина линии: расстояние между ядрами, участвующими в ковалентной связи. Ионные, полярные ковалентные и неполярные ковалентные связи. Классификация химических облигаций. Как оценить степень ионного или ковалентного характера химической связи? Атомы менее электроотрицательны: δ.
Атом углерода образует по-разному длинные цепи и циклы. Среди углеродных связей одиночные, двойные или тройные. На атомах углерода связываются другие элементы. Они состоят из фрагментов, которые различаются по размеру и цвету, связанные трубки разной длины = компьютерные модели работают программы для создания визуализации молекулы геометрии и измерения характеристик, например.
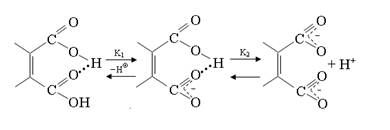
Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K 1) аномально велика, а вторая (K 2) аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила:
Для карбоновых кислот характерно образование Н-комплексов и ассоциатов псевдоциклической структуры:
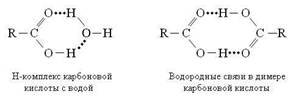
Межмолекулярные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии димерные структуры частично сохраняются. Кстати, образование димера карбоновой кислоты помогает дать ответ на давний вопрос, что в большей степени определяет прочность водородной связи – кислотность группы Х–Н или основность фрагмента В. Уксусная кислота (pK a = 4,7) по кислотности на несколько порядков уступая трихлоруксусной (pK a = 0,6), тем не менее образует более прочный димер. Основность протоноакцептора имеет приоритет перед кислотностью протонодонора.
Известно, что геминальные дигидроксипроизводные являются нестабильными соединениями – дегидратируясь легко превращаются в соответствующие альдегиды или кетоны. Хлоральгидрат является одним из немногих примеров, когда структура гем-диола является стабильной. И причину этого объясняют как сильным отрицательным индукционным эффектом (-I-эффект) трихлорметильной группы, так и наличием внутримолекулярных Н-связей:

Не имея возможности остановиться на других примерах влияния водородной связи на свойства органических соединений, приведем таблицу сравнительных характеристик проявления меж- и внутримолекулярных Н-связей (табл. 1 (по )).

Образование внутри- и межмолекулярных водородных связей может существенно влиять на ход и скорость химических реакций. К сожалению, несмотря на значительное количество работ, посвященных этому вопросу, широких обобщений, которые имели бы предсказательную силу, не последовало. В самых общих чертах показано, что скорость реакций может уменьшаться или увеличиваться в зависимости от того, как при образовании Н-связи будет перераспределяться электронная плотность в реакционных центрах молекулы. Такие вопросы, как природа промежуточных продуктов или активированного комплекса, изменение термодинамических функций, влияние соседних групп, не получили должного развития. Более определенно дана оценка роли растворителя.
Известно много эмпирических подходов. Так, в реакциях алкилирования соединений, содержащих связи О–Н, S–H, N–H, введение в реакционную среду фторида калия (фторид-анион F− является самым эффективным протоноакцептором) значительно увеличивает скорости реакций и выходы продуктов алкилирования. Большая роль водородным связям отводится в реакциях, проводимых в растворителях, способных образовывать Н-связи как с исходными соединениями, так и с продуктами их взаимодействия.
Заключение
Представленная информация о водородной связи указывает на ее широкую распространенность и многообразие условий, в которых она может возникать. Описание природы Н-связей является менее строгим, чем, например, трактовка валентных химических связей. Не существует даже общепринятого определения Н-связей. В то же время реальное существование водородных связей и их способность влиять на структуру и свойства веществ общепризнаны и давно приняты на вооружение химиками-практиками.
Роль водородных связей в живой материи определяется не только тем, что без Н-связей нельзя себе представить структуру белков (носителей жизни) или двойную спираль нуклеиновых кислот. Без водородных связей совершенно иными были бы физические и химические свойства самого распространенного вещества на Земле – воды, в которой и зародилась жизнь.
Теория химического строения органических соединений, выдвинутая А. М. Бутлеровым во второй половине прошлого века (1861 г.), была подтверждена работами многих ученых, в том числе учениками Бутлерова и им самим.
Первое положение. Атомы в молекулах соединяются в определенном порядке в соответствии с их валентностью. Углерод во всех органических и в большинстве неорганических соединений четырехвалентен.
Последнюю часть первого положения теории легко объяснить тем, что в соединениях атомы углерода находятся в возбужденном состоянии:
Наличие четырех одиночных электронов на внешнем уровне определяет валентность углерода, равную четырем.
Атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные цепи:
Открытые разветвленные
- открытые неразветвленные
- замкнутые
Порядок соединения атомов углерода в молекулах может быть различным и зависит от вида ковалентной химической связи между атомами углерода - одинарной или кратной (двойной и тройной).
Второе положение.
Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул (от порядка соединений атомов в молекулах и характера связей).
Это положение объясняет явление изомерии. Вещества, имеющие одинаковый состав, но разное химическое или пространственное строение, а следовательно, и разные свойства, называют изомерами.
Третье положение. Свойства веществ зависят от взаимного влияния атомов в молекулах.
Например, в уксусной кислоте в реакцию со щелочью вступает только один из четырех атомов водорода. На основании этого можно предположить, что только один атом водорода связан с кислородом:
С другой стороны, из структурной формулы уксусной кислоты можно сделать вывод о наличии в ней одного подвижного атома водорода, то есть о ее одноосновности.
Четвертое положение. Свойства веществ определяются их строением, и, наоборот, зная строение, можно прогнозировать свойства.
Типы химических связей в органических соединениях. Валентные состояния атомов углерода, кислорода, азота. Гибридизация; сигма- и пи-связи (σ- и π-связи) . Двойная и тройная связь
Гибридизация - это смешивание валентных электронных облаков и образование качественно новых, равноценных гибридных валентных электронных облаков.
Число гибридных орбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов.
У атома углерода в возбужденном состоянии 4 валентных электрона
Они неравноценны: s-электрон сферической формы, р-электроны имеют форму восьмерки и направлены по осям х, у, z.
При образовании химических связей у атома углерода происходит гибридизация. В зависимости от вида гибридизации атомы углерода могут находиться в трех валентных состояниях:
I валентное состояние. Для него характерна sр 3 -гибридизация . В случае sp 3 - гибридизации образуется четыре гибридных облака, которые направлены из центра тетраэдра к его вершинам. Угол между осями гибридных электронных облаков оказывается равным 109°28». Так образуется метан и его гомологи - алканы с общей формулой
Алканы в пространстве имеют зигзагообразное строение - это ряд тетраэдров, соединенных своими вершинами:
II валентное состояние - sр 2 -гибридизация . Если происходит sр 2 -гибридизация, то образуется три гибридных валентных облака, которые лежат на плоскости под углом 120°.
Они образуют на плоскости три сигма-связи. Четвертая связь с соседним атомом углерода образуется в перпендикулярной плоскости двумя р-электронами, которые не участвовали в гибридизации. Так образуется этилен и его гомологи с общей формулой CnH 2n .
III валентное состояние - sp-гибридизация . В случае sp-гибридизации образуются два гибридных облака, которые лежат на осевой линии, соединяющей ядра двух атомов под углом 180°. Они образуют две сигма-связи по осевой линии - с водородом и углеродом. 2р-электрона, которые не участвовали в гибридизации, образуют с соседним атомом углерода две П-связи в двух взаимноперпендикулярных плоскостях. Так образуется ацетилен и его гомологи с общей формулой CnH 2n + 2 .
H–C≡C–H ацетилен
σ-Связь – ковалентная связь, образованная при перекрывании s -, p - и гибридных АО вдоль оси , соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р -АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи.
При двойном связывании атомов углерода первые 2p -орбитали создают σ-связь, а вторые - π-связь; в этом случае образуется остов молекулы этилена C 2 H 4 .
При тройном связывании (одна σ-связь, две π-связи) образуется остов молекулы ацетилена C 2 H 2:
H–C≡C–H ацетилен
Конец работы -
Эта тема принадлежит разделу:
Предмет органической химии. Органическая химия как основа создания новых материалов. Связь органической химии с биологией и медициной
Предмет органической химии Органическая химия как основа создания новых материалов Связь органической химии с биологией и... Классификация реакций по характеру изменения химической связи и по... Химическая реакция превращение одних веществ в другие процесс связанный с разрывом одних и образованием других...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Предмет органической химии. Органическая химия как основа создания новых материалов. Связь органической химии с биологией и медициной.
Органической химией изначально называлась химия веществ, полученных из организмов растений и животных. С такими веществами человечество знакомо с глубокой древности. Люди умели получать уксу
Реакции замещения
Галогенирование. Свободно-радикальный характер хлорирования
Хлорирование метана:
CH4 + Cl2 hν → CH
Алкены. Гомологический ряд, изомерия, номенклатура.
Алкенами называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса - этилен СН2 = СН2, в связи с чем алкены также н
Правило Марковникова
При присоединении галогенводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода (в месте разрыва двойно
Диены (непредельные углеводороды с двумя двойными связями). Типы диенов.
Диены (алкадиены) - ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле СnН2n-2
Синтетические каучуки. Понятие о линейных и пространственных полимерах.
Полимеризация 1,3-диенов может протекать либо по типу 1,4-присоединения, либо по смешанному типу 1,2- и 1,4-присоединения. Направление присоединения зависит от условий проведения реакции.
Методы получения ацетилена и его гомологов.
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C® HCºCH + 3H
Гидрирование
Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3–C
Методы получения бензола и его гомологов.
Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использование
Химические свойства толуола.
1.Нитрование толуола приводит к образованию тринитропроизводного:
(тринитротолуол).
2.Галогенирование (в кольцо в присутствии катализатора броми
Методы получения монохлорпроизводных алканов.
1. Галогенирование алканов на свету
CH4 + Cl2 hν → CH3Cl + HCl
2. Присоединение галогенводородов к алк
Спирты. Гомологический ряд, изомерия, номенклатура
Спирты – органические соединения, содержащие одну или несколько гидроксильных групп, соединенных с углеводородным радикалом. Функциональная группа – ОН. Число гидроксильных групп определяет атомнос
Окисление спиртов
а). Горение: СnH2n+2O + (1,5n +0,5)O2 ® nCO2 + (n +1)H2O.
б). Окисление кислородом воздуха в присутствии катали
Особенности реакции дегидратации и окисления по сравнению с теми же реакциями для одноатомных спиртов.
При дегидратации многоатомных спиртов образуются циклические соединения (в отличии от многоатомных)
Дегидратация многоатомных спиртов
диоксан
Окисление м
Ароматические амины. Анилин, толуидины - получение, химические свойства.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-эле
Азокрасители.
Азокрасители являются самой многочисленной и наиболее важной группой органических красителей. На их долю приходится почти треть от всего производства красителей, а по числу представителей они стоят
Изомерия, номенклатура альдегидов и кетонов
Альдегиды и кетоны относятся к карбонильным соединениям и содержат карбонильную группу. В альдегидах карбонильная группа обязательно связана с атомом водорода (находится в пол
Реакции присоединения к карбонильной группе водорода, бисульфита натрия, синильной кислоты, спиртов (образование ацеталей и полуацеталей).
1. Присоединение водорода (восстановление альдегидов и кетонов до первичных и вторичных спиртов):
2. Присоединение воды (гидратация) – обратимый процесс (ги
Реакции с участием альфа-водородных атомов -галогенирование, реакции альдольного и кротонового типа.
Ослабление связи в СН2-группе углеводородного радикала, соседней с функциональной группой альдегида (a-положение), приводит к тому, что именно эти атомы водорода преимущественно заменяют
Формальдегид
Бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях, токсичен.
Водный раствор формальдегида - формалин - вызывает денатурацию белков, поэтому он пр
Некоторые предельные одноосновные кислоты
Формула
Название
систематическое
тривиальное
HCOOH
метановая
муравьиная
Строение карбоксильной группы и карбоксилат-аниона.
Карбоксильная группа сочетает в себе две функциональные группы - карбонил и гидроксил, взаимно влияющие друг на друга:
Кислотные свойства карбоновых кислот обусловлены смещ
Мыла. Жиры. Понятие о биохимии жиров.
Жиры - сложные эфиры глицерина и высших одноатомных карбоновых кислот.
Общее название таких соединений - триглицериды или триацилглицерины, где ацил - остаток карбоновой ки
Гомологический ряд
Тривиальное название
Название по ИЮПАК
Формула
Название солей
Щавелевая кислота
Этандиовая кисл
Щавелевая кислота, получение, свойства.
Щавелевая кислота (этандиовая кислота) НООССООН - двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойств
Кротоновая, фумаровая, малеиновая кислоты
Для этилен-1,2-дикарбоновой кислоты возможны две пространственные конфигурации:
Эта кислота действительно существует в двух формах, известных под названиями
Бензойная кислота, получение производных. Карбоксильная группа как ориентант.
Реакции бензойной кислоты обусловлены наличием бензольного кольца и карбоксильной группы, а также их взаимным влиянием.
Карбоксильная группа как ориентант второго рода, направляет вновь вв
Оксикислоты. Гомологический ряд, номенклатура.
Оксикислоты характеризуются наличием в молекуле кроме карбоксильной еще гидроксильной группы О–Н, их общая формула R(OH)n(COOH). Формально простейшей оксикислотой будет хорошо изв
Отдельные представители - молочная, яблочная, винная, лимонная кислоты.
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода
Стереоизомерия. Учение об асимметрическом (хиральном) атоме углерода. Оптическая изомерия как один из видов пространственной изомерии
Стереоизомерия (пространственная изомерия) - вид изомерии, обусловленный различиями в пространственном расположении отдельных групп и атомов в молекулах при одном и том же порядке их связей между с
Пировиноградная кислота, ее получение. Химические свойства функциональных групп пировиноградной кислоты, превращение ее в аланин.
При окислении гидроксикислот, содержащих первичный спиртовой гидроксил, образуются альдегидокислоты, а при окислении гидроксикислот со вторичным спиртовым гидрокси-лом образуются кетонокислоты:
Ацетоуксусный эфир, получение сложно-эфирной конденсацией.
Ацетоуксусный эфир получают по реакции кляйзена. исходным продуктом в этой реакции является этиловый эфир уксусной кислоты. Катализирует этот процесс натрия алкоголят. Эта реакция походит на альдол
Двойственная реакционная способность ацетоуксусного эфира и его натриевого производного
Наличие кетонной и енольной форм доказывается с помощью химических реакций. Кетоформа ацетоуксусного эфира взаимодействует с гидроксиламином с образованием оксима; восстанавливается водородом в мом
Структурная изомерия и номенклатура аминокислот
Аминокислоты содержат одновременно амино- и карбоксильную группы. Изомерия и номенклатура аминокислот аналогичны таковым для оксикислот. В зависимости от взаимного расположения амин
Понятие о белковых веществах. Строение, гидролиз белков.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е. представляют собой продукт поликонденсации α-аминокислот.
В состав белков входит 20 различных аминокис
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter