Периодический закон изменения свойств элементов. Биология и химия: Периодический закон Д.И. Менделеева, Доклад
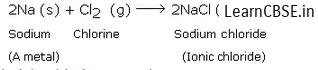
Физический смысл химической периодичности."Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса".
"свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
Тенденция атома на получение электронов уменьшается при сходе в группе периодической таблицы. Когда мы перемещаемся сверху вниз в группу 17, к атомам каждой ступени добавляется новая оболочка электронов, из-за которой увеличивается размер атома. Ядро проникает глубже внутри атома, из-за чего уменьшается притяжение ядра для входящего электрона, из-за которого атом не может легко образовывать отрицательные ионы, и, следовательно, электроотрицательный характер уменьшается. Вопрос 32: Почему размер атомов постепенно уменьшается при переходе от натрия к хлору в третьем периоде периодической таблицы?
Физический смысл химической периодичности.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Гелий и неон являются нереакционными газами. Что, во всяком случае, имеют свои атомы вместе? Когда мы перемещаемся слева направо за один период, атомный №. элементов увеличивается, т.е. число протонов и электронов в атомах увеличивается. Атомы гелия и неона полностью заполнены самыми удаленными электронными оболочками. Вопрос 33: В современной периодической таблице почему кобальт с более высокой атомной массой 93 появляется перед никелем, имеющим более низкую атомную массу 71? Почему в периодической таблице Менделеева не может быть задано фиксированное положение водорода?
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента. Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns 2 np 6).
Современная периодическая таблица упорядочивает элементы по возрастающим атомным номерам. Итак, атомный номер кобальта наступает первым, а атомное число никеля - позже. Это означает, что водород обладает некоторыми свойствами в щелочных металлах. Водород также похож на галогены в некоторых свойствах. Таким образом, периодический закон Менделеева не мог присвоить правильную позицию водороду в периодической таблице. Вопрос 34: Каковы периоды и группы в периодической таблице? Дайте две характеристики каждой из них.
В терминах электронных конфигураций объясните изменение размера атомов элементов, принадлежащих тому же периоду и той же группе. Данный наряду с ним является частью периодической таблицы. Что происходит с размером атомов? Что происходит с их металлическим характером? Назовите два свойства элементов, величины которых изменяются при переходе сверху вниз в группу периодической таблицы. Каким образом они меняются? При необходимости перепишите следующую инструкцию после исправления. Группы имеют элементы с последовательными атомными числами.
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns 2 np 6) химически инертны.
Характеристики: Элементы в периоде имеют последовательные атомные номера. Нет. элементов в периоде фиксируется максимальным числом. электронов, которые могут быть размещены в различных оболочках. Характеристики: Элементы в группе не имеют последовательных атомных чисел. Размер атома уменьшается при перемещении слева направо в течение периода. Электронная конфигурация атомов увеличивается в одной и той же оболочке. При переходе в группу периодической таблицы размер атома увеличивается. Нет. электронных оболочек в атомах постепенно увеличивается, и электронная конфигурация также увеличивается, из-за чего увеличивается атомный размер.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns 2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Атомный размер постепенно увеличивается от лития до франция. Металлический характер увеличивается от лития до франция. При спуске в группу периодической таблицы размер атома и металлический характер возрастают. Когда мы перемещаемся сверху вниз в группу 1 щелочных металлов, размер атомов постепенно увеличивается от лития до франция. В группе 1 щелочных металлов литий является наименее металлическим элементом, тогда как франций является самым металлическим элементом. Вопрос 35: Объясните, почему первый период современной периодической таблицы имеет только два элемента, тогда как второй период имеет восемь элементов.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
Почему элементы в одной группе показывают сходные свойства, но элементы в разных группах показывают разные свойства? Для каждой из следующих триад назовите элемент с характеристиками, указанными ниже. Укажите одну причину сохранения фтора и хлора в той же группе периодической таблицы. Каковы достоинства современной периодической таблицы элементов?
Вопрос 36: Что такое группа в периодической таблице? В какой части группы вы отдельно ожидали бы, что элементы имеют наибольший металлический характер - самый большой атомный размер? В каком отношении свойства элементов 1-й группы отличаются от свойств элементов группы 17? Их химическая реактивность возрастает по группе. Они являются электроположительными по своей природе и увеличиваются по группе. В то время как элементы группы 17 имеют 7 валентных электронов. Их химическая реактивность уменьшается по группе.
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Какие два элемента принадлежат к одной группе? Какие два элемента относятся к тому же периоду? Приведите причины для вашего выбора. Состояние: число валентных электронов. Валентность металла или неметаллическое название элемента. Решетка: 2. Металл. Вопрос 63: На следующей диаграмме показана часть периодической таблицы, в которой элементы расположены в соответствии с их атомными номерами. Выберите букву, представляющую металл валентности. Выберите букву, которая представляет собой неметаллический валентный раствор.
Каково количество валентных электронов в атоме? Какова его валентность? Как называется элемент? Решение: Неметалл. 6. 2. Кислород. К какой группе периодической таблицы она принадлежит? Решение: Группа 1. Вопрос 68: Элемент А имеет атомный номер. Какова будет формула его оксида? Выберите букву, которая представляет собой благородный газ. Выберите букву, которая представляет собой галоген. Ковалентная связь. Ионная связь. Какие два элемента образуют ковалентное соединение?
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
|
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН 3) - основания, VI и VII групп (Н 2 Э и НЭ) - кислоты.
Вопрос 79: Неметалл А является важной составляющей нашей пищи и большинства видов топлива вокруг нас. Он является основой периодической таблицы и утверждает, что физические и химические свойства химических элементов, как правило, повторяются систематически по мере увеличения атомного номера.
Первые попытки классифицировать химические элементы
Развитие электрохимии в этот период британскими химиками Хамфри Дэви и Майклом Фарадеем привело к открытию новых элементов. Второе продвижение - это интерпретация причины периодичности элементов в терминах теории Бора электронной структуры атома Бора.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается.
Основы всего современного развития химии были установлены в период после предложения и развития Менделеева по атомной структуре. После внесения поправок в массы атомов и после обнаружения новых элементов, занимавших пустые квадраты таблицы Менделеева, тем не менее некоторые аномалии сохранялись в периодической таблице.
В соответствии со всем этим стало очевидно, что возрастающая атомная масса является несовершенным критерием упорядочения для структурирования периодической таблицы. Действительно, причиной этих аномалий являются то, что атомные массы представляют собой средние массы смесей изотопов, составляющих каждый элемент, и связаны с относительными количествами каждого класса атомов в смеси изотопов. То есть атомная масса не является свойством класса атома, а элемента или множества атомов с равным зарядом ядра.
По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
Пример:
На основании периодической таблицы охарактеризуйте химический элемент с порядковым номером 21.
Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
Масса атома зависит от обилия каждого изотопа в смеси и соответственно изменяется для каждого элемента. Следующий важный шаг в развитии периодического закона связан с работой Мозли, который при изучении рентгеновских спектров обнаружил, что характерные линии рентгеновских спектров разных элементов меняют свою частоту в постоянная сумма при переходе от одного элемента к другому в периодической таблице.
В Мозли обнаружил, что экспериментально ядерный заряд является физической константой атомов и тесно связан с его структурой, будучи равным атомному номеру. От открытия закона Мозли периодическая таблица основана на ядерном заряде, а не на атомном весе. Это изменение интерпретации периодического закона не может выдвинуть никаких принципиальных оснований, поскольку точность общих постулатов на основе новых экспериментальных данных является необходимым условием развития науки.
1. Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
2. Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов e; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
При анализе длины волн и волновых чисел лучей, соответствующих различным сериям рентгеновского спектра, было найдено, что они соответствуют соотношению. Вышеприведенное уравнение называется законом Мозли. Эти результаты показали, что существует фундаментальная величина, которая неуклонно возрастает, когда мы переходим от одного элемента к другому. Эта величина, очевидно, является электрическим зарядом ядра или ядерного заряда.
Когда элементы расположены в последовательном порядке их ядерных зарядов, аномалии, возникающие при упорядочении их по их возрастающим атомным массам, исчезают. Ядерный заряд соответствует порядковому числу в периодической таблице или атомному номеру, демонстрируя, что истинным базисом периодического закона являются не атомные массы, а положительные заряды атомных ядер, численно выраженные атомными числами соответствующие химические элементы.
3. Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
4. Сравнить с соседями (по периоду, по группе).
a) Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия): 65 21 Sc - +21; число протонов p 1 1: 21 Sc - 21 p 1 1 ; число электронов e: 21 Sc - 21e; число нейтронов n 0 1 = Ar - Z = 65 - 21 = 44 - 44n 1 0
Соответственно, текущий периодический закон прочно закрепляется в атомной структуре химических элементов и выражается следующим образом. «Физические и химические свойства элементов являются функциями электронных конфигураций их атомов, которые периодически меняются по мере увеличения атомного номера», постулат, известный как Периодический закон Мозли.
То есть свойства элементов периодически меняются при упорядочении в соответствии с их ядерными зарядами и при каждом количестве элементов свойства повторяются. Это упорядочение показывает периодические тенденции, как элементы с аналогичным поведением в одном столбце.
Формула состава атома:
2.4. Периодический закон и современная теория строения атома
Если форма таблицы элементов за время ее существования практически не претерпела существенных изменений, то сам принцип расположения в ней химических элементов коренным образом изменился. Современная концепция периодичности свойств химических элементов базируется на квантово-механи- ческой модели строения атома.
Причины периодичности свойств элементов по вполне объективным причинам (теории строения атома просто не существовало!) к концу XIX века установлены не были и периодический закон на том этапе развития правильнее называть постулатом. История химии содержит немало примеров, когда на ка- ком-то этапе осмысления экспериментальных данных рождалась некая гипотеза (подчас достаточно безумная для своего времени), не находящая объяснений и не подтверждаемая точными математическими выкладками. И только время расставляло все по своим местам. Безумная, сенсационная гипотеза со временем находила самое естественное обоснование и занимала свое скромное место в составе гораздо более общей теории или системы понятий. Так, например, закон Лавуазье-Лапласа превратился в иллюстрацию общего закона сохранения энергии, а термохимия стала лишь областью химической термодинамики.
Современную теорию строения атома можно уподобить яркому лучу прожектора, высветившему систему элементов, мерцающую до этого в неверном пламени свечи, колеблющемся на ветру. Все стало четким и понятным. Правда, на сегодняшний день в таблице Д. И. Менделеева немало аномалий. Но они лишь подчеркивают многогранность и многоликость Природы, не терпящей ординарности и примитивной прямолинейности в описании ее явлений.
После установления соответствия между порядковым номером элемента в таблице Д. И. Менделеева и зарядом ядра его атома (Генри Мозли, 1913 г.) стало очевидным, что именно заряд ядра атома предопределяет последовательность расположения элементов.
Периодичность в изменении свойств химических элементов не связана непосредственно с атомными массами, однако погрешность в их определении в менделеевские времена была настолько велика, что последовательность в расположении элементов по атомным массам практически совпала с той, которая принята сегодня – в порядке возрастания зарядов ядер их атомов (атомных номеров). Сегодня, когда точность измерений атомных масс достаточно высока, существуют по крайней мере три пары элементов, расположение которых не соответствует значениям их атомных масс. Это кобальт и никель, аргон и калий, теллур и иод. Последняя аномалия сохранилась со времен Д. И. Менделеева, хотя он и ожидал, что действительная атомная масса теллура окажется меньше, чем у иода. Впрочем, это не помешало ему расположить эти элементы правильно.
Теория строения атома позволила дать четкое обоснование периодической системе Д. И. Менделеева, объяснив причины периодичности изменения свойств элементов. Современная формулировка периодического закона имеет вид:
свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер их атомов.
Химические элементы располагаются в системе в порядке возрастания их атомных номеров, а, следовательно, зарядов ядер их атомов и, соответственно, числа электронов. При переходе от одного элемента к другому происходит закономерное увеличение числа электронов на единицу. При этом электроны заполняют энергетические уровни и подуровни в соответствии с рассмотренными выше правилами (принцип наименьшей энергии, принцип Паули).
В атомах элементов 1 периода застраивается первый энергетический уровень:
H 1s1 He 1s2 .
Этот период – самый короткий в системе элементов, т.к. первый энергетический уровень способен "вместить" только два электрона.
2 период включает в себя восемь элементов от лития до неона. В атомах этих элементов происходит застройка второго энергетической уровня, включающего два подуровня: s и p. Емкость второго энергетического уровня составляет 8 электронов – s2 p6 . Первые два элемента – литий и бериллий – относятся к семейству s-элементов в их атомах заполняется 2s-подуровень:
Li 2s1 Be 2s2 .
B 2s 2 2p1
C 2s 2 2p2
N 2s2 2p3
O 2s2 2p4
F 2s2 2p5
Ne 2s2 2p6 .
Элементы 3 периода характеризуются застройкой третьего энергетического уровня. В соответствие с конфигурацией 3s23p6 таких элементов восемь – от натрия до аргона. Вновь период открывается двумя s-элементами:
Na 3s1
Mg 3s2 .
За ними следуют шесть элементов p-семейства:
Al 3s2 3p1
Si 3s2 3p2
P 3s2 3p3
S 3s2 3p4
Cl 3s2 3p5
Ar 3s2 3p6 .
Несмотря на то, что на третьем энергетическом уровне имеется еще и d- подуровень, d-элементов в 3 периоде нет. Это объясняется тем, что подуровень 3d заполняется после 4s (см. с.32). Следовательно, d-элементы могут появиться только в4 периоде . Число элементов в этом периоде составляет 18, что отвечает электронной конфигурации 4s2 3d10 4p6 . 4 период (как и два предыдущих) начинается с двух s-элементов (K и Ca) и завершается шестью p-элементами (от Ga до Kr). Однако между ними вклиниваются десять элементов, в атомах которых происходит застройка 3d-подуровня (элементы d-семейства ):
Sc 4s2 3d1
Ti 4s2 3d2
V 4s2 3d3
Cr 4s1 3d5
Mn 4s2 3d5
Fe 4s2 3d6
Co 4s2 3d7
Ni 4s2 3d8
Cu 4s1 3d10
Zn Ar]4s2 3d10 .
Следует обратить внимание на электронные конфигурации элементов Cr и Cu: здесь учтен эффект, называемый "электронным перескоком" (см. с. 35).
5 период построен аналогично предыдущему и содержит также 18 элементов: два элемента s-семейства (Rb и Sr), десять d-элементов (от Y до Cd) и шесть p-элементов (от In до Xe).
Увеличение числа элементов до 32 в 6 периоде вызвано застройкой f- подуровня, вмещающего в себя 14 электронов. 14 элементов, в атомах которых застраивается третий снаружи f-подуровень, относят к f-элементам . f-элементы
6 периода называют лантаноидами (по названию их "родоначальника" – лантана). Элементы данного электронного семейства принято выносить за пределы таблицы в виде отдельной строки. Последнее объясняется тем, что расположение элементов по вертикали – по группам элементов – предполагает аналогичное строение валентного электронного слоя (электронов внешнего уровня и предвнешнего d-подуровня). По этой причине все лантаноиды должны находиться в той же клетке таблицы, что и сам лантан. Удобнее, поставив у лантана знак сноски, выделить эти элементы в отдельную строку.
7 период является незавершенным. В настоящее время можно с уверенностью утверждать о наличии в нем двух элементов s-семейства (Cs и Ba), четырнадцати элементов f-семейства –актиноидов (от Th до Lr) и семи d- элементов (от Ac до Mt). Имеется предварительная информация о синтезе некоторых элементов с большими порядковыми номерами. Так, по сообщениям из Германии в 1994 г. там синтезированы элементы 110 и 111 в количестве нескольких атомов. Стабильность элемента 111 оценивалась временным интервалом в 0.0015 секунд. 28 октября 2000 г. средства массовой информации сообщили о синтезе элемента с порядковым номером 116, время "жизни" которого оценивалось 50 миллисекундами, а в феврале 2004 – о синтезе элементов 113 и 115. Это произошло в России, в Дубне, в Объединенном институте ядерных исследований. Правда, сообщения носили предварительный характер.
Работы по синтезу новых химических элементов в настоящее время активно продолжаются в России, США и Германии. Есть предположения о том, что элементы с порядковыми номерами в интервале 122–124 должны обладать большей стабильностью, чем элементы 100–112.
Итак, подводя итоги данного рассмотрения, можно заключить:
периодическая система Д.И. Менделеева является естественной клас сификацией химических элементов по электронным конфигурациям их атомов.
Действительно, систему элементов можно рассматривать как иллюстрацию приведенного на с. 33 ряда заполнения энергетических подуровней:
переход от одного элемента к другому сопровождается закономерным изменением электронной конфигурации их атомов: каждый вновь поступающий электрон занимает тот или иной энергетический подуровень в строгом соответствии с рядом заполнения. Число элементов в каждом периоде определяется емкостью соответствующего энергетического уровня.
Если составить электронные формулы всех известных на сегодняшний день химических элементов и расположить их по принципу аналогии электронных конфигураций валентного слоя, то можно самостоятельно воссоздать таблицу Д. И. Менделеева.
Понимание взаимосвязи между электронной конфигурацией валентного слоя и положением элемента в периодической системе позволяет составлять электронную формулу атома более рациональным путем. Например, электронные формулы элементов с порядковыми номерами 43 (технеций) и 83 (висмут) можно вывести, исходя из следующих соображений.
Технеций располагается в таблице в 5 периоде, подгруппе VIIB (побочная подгруппа VII группы). Это говорит о том, что последний энергетический уровень в его электронной формуле – пятый, а число валентных электронов, равное номеру группы – семь. Чтобы выяснить, как распределены семь его валентных электронов по энергетическим подуровням, проанализируем расположение элемента в периоде. В своем периоде технеций стоит после двух элементов s- семейства (рубидия и стронция)пятым по счету d-элементом. Следовательно, его валентные электроны имеют конфигурацию: 4d5 5s2 . Энергетические подуровни, предшествующие данным, застроены полностью. Это отвечает электронной формуле благородного газа предыдущего периода– криптона. Поэтому можно записать электронную формулу технеция в виде: 4d5 5s2 или пол-
ностью: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2 .
Висмут – элемент 6 периода, подгруппы VA (главная подгруппа группы V). Следовательно, внешний (последний в формуле) энергетический уровень, заполняемый электронами его атома – шестой, а число валентных электронов (равное номеру группы) – пять. Шестой период начинается с двух s-элементов
(цезий и барий), обеспечивающих конфигурацию 6s2 . Далее следует семейство d-элементов, которому соответствует конфигурация 5d10 . Один из элементов d- семейства – лантан – добавляет конфигурацию 4f14 за счет семейства лантаноидов. Наконец, завершается период семейством p-элементов, в котором висмут занимает третью позицию (после таллия и свинца). Следовательно, конфигурация валентного слоя имеет вид: 6s2 6p3 . Все предыдущие электронные слои застроены полностью. Это позволяет вывести сокращенную
4f14 5d10 6s2 6p3
1s 22s 22p 63s 23p 63d 104s 24p 64d 104f 145s 25p 65d 106s 26p 3
электронные формулы висмута.
Теория строения атома позволила ответить и на вопрос о причинах периодичности свойств элементов . Под периодической зависимостью понимается повторение значений некоторой функции через определенный интервал значений аргумента. Поскольку свойства элементов определяются в первую очередь структурой валентного слоя, то в пределах периода, где эта структура постоянно изменяется в результате добавления электрона при переходе от одного элемента к другому, аналогии в свойствах элементов не наблюдается. Однако, как только период заканчивается, и мы переходим к следующему, электронные конфигурации валентного слоя начинают повторяться. Элементы одной и той же подгруппы (главные подгруппы образованы s- и p-элементами, апобочные подгруппы – d- и f-элементами) демонстрируют аналогию в свойствах, т.к. их атомы характеризуются сходными электронными конфигурациями. Например, щелочные металлы – элементы главной подгруппы I группы (подгруппа IA) обладают электронной конфигурацией s1 , а галогены – элементы главной подгруппы VII группы (подгруппа VIIA) – конфигурацией s2 p5 .
причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций валентного слоя электронов их атомов.
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter