За счет чего образуется ковалентная неполярная связь. Ковалентная неполярная (неметалл-неметалл). Ковалентная полярная - образование
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Простая и практическая теория сигма-связей и пи-связей

В предыдущей теме вы узнали о одиночных, двойных и тройных облигациях. 
Когда вы учились, вы видели, что в текущей квантовой модели электроны в валентном слое лежат в областях вероятности, называемых орбиталями. 
Таким образом, когда распределение электронов происходит из атома, а электроны получаются из валентного слоя, распределение показывает количество электронов на каждой из этих орбиталей.
Впервые ковалентная была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.

Когда два атома азота подходят для создания ковалентной связи, происходит перекрытие этих орбиталей, образующих связь. 
В зависимости от того, как это перекрытие орбиталей производится, образуются сигма-связи и пи-связи. Сигма-связи происходят путем фронтального перекрытия орбиталей в одном направлении.


Ниже представление сигма и пи-связей одновременно. 
Они сильнее; Это последние соединения, чтобы вступить в химическую реакцию; Разрешить вращение вокруг перекрывающейся оси. Они слабее, чем сигма-облигации; Они являются первыми соединениями, которые проникают в химическую реакцию; Они не позволяют вращать атом, поскольку они параллельны. Другим очень важным вопросом при исследовании ковалентного связывания является полярность связи.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Полярность ковалентной связи определяется путем сравнения характеристик аметилов, участвующих в связывании. Всякий раз, когда существует различие в электроотрицательности между аметилами, участвующими в связывании, возникает поляризация связи. Поляризация происходит из-за того, что более электроотрицательный аметал тянет на себя электроны связи, получая отрицательный заряд и, следовательно, отрицательно поляризован.
Хотите узнать больше об электроотрицательности? У менее электроотрицательного атома был электрон, вытягиваемый другим атомом, вызывающий отрицательный заряд дефицита, то есть он стал более положительным. Пример соединения между водородом и хлором, в котором хлор является более электроотрицательным.
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Различия между полярной ковалентной связью и полярной молекулой
Посмотрите, как соединение стало поляризованным, с избыточным отрицательным зарядом на стороне хлора. 
Ниже связь между водородами, заметим, что электронное облако остается однородно распределенным, становясь неполярной связью. 
Вы должны обратить пристальное внимание, чтобы не путать полярную связь с полярной молекулой. Это совершенно разные вещи. Эта путаница очень распространена среди студентов, но с вами она не должна быть одинаковой.
Более наглядно это показано на картинке.

Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Ковалентная полярная связь
В то время как первое относится исключительно к полярности связи между двумя атомами аметилов с различными электроотрицательностями, последнее относится к полярности всей молекулы. То есть полярность молекулы обусловлена полярностями всех связей, составляющих молекулу.
Полярность молекулы может быть определена только после того, как она узнает о полярности каждой связи и знает, что такое молекулярная геометрия. Только после определения этих двух параметров можно сделать вывод о полярности молекулы. Если вам интересно узнать об этих предметах, нажмите на слова: Молекулярная геометрия и полярность молекул. Пример молекулы аммиака.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Аммиак является полярной молекулой, поскольку он имеет полярные ковалентные связи и его пирамидальная молекулярная геометрия способствует образованию полярной молекулы. 
С другой стороны, посмотрите на молекулу углекислого газа, также называемую углекислым газом. Хотя связи полярны, поскольку углерод и кислород имеют разные электроотрицательности, линейная молекулярная геометрия приводит к отмене электрических диполей противоположных направлений, что делает молекулу неполярной.

Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Типы ковалентной связи
Тема полярности молекул очень важна для изучения растворимости химических соединений или растворимости органических соединений. Мы доходим до конца этой статьи о ковалентном связывании. Они будут рады узнать, что вы их помнили!
- Оставьте свой комментарий!
- Это может быть критика или комплимент.
- Ваше участие очень важно для нас!
- Поделитесь этим контентом со своими друзьями!
Как определить ковалентную связь
Химические связи. Представление, которое описывает химические связи и их виды. Связь р происходит только после образования связи σ и способствует образованию кратных связей, она слабее связи σ, поэтому соединения с множественными связями более реакционноспособны, чем соединения с одинарными связями. - Молекулярная орбиталь π может возникать путем перекрытия.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
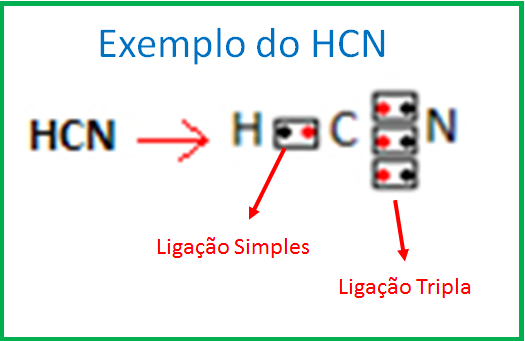
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и общественные электроны не принадлежат в равной степени двум атомам. Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Более электроотрицательный атом при связывании удерживает пару электронов сильнее, чем другой электропоэтический атом. Ионы в ионных соединениях притягиваются друг к другу электростатическими силами. Таким образом, образующаяся связь с ее свойствами не отличается от ковалентной связи.
Каждый атом в металлической структуре окружен большим числом атомов, чем число его валентных электронов, участвующих в образовании связей. Таким образом, электроны могут свободно перемещаться вокруг катионов металлов, распределенных в регулярной сетке.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Неполярные ковалентно связанные вещества: нерастворимые в воде, растворимые в неполярных растворителях не проводят электрический ток Полярные и ионные соединения: водорастворимые, нерастворимые в неполярных растворителях свинец в расплаве или растворе в металлической связи. свинцовое электричество и тепло являются ковкими и буксируемыми.
Кристалл - это геометрическое тело, ограниченное поверхностями кристалла, которые встречаются по краям, и они сходятся в вершинах. Изоморфизм - это способность различных веществ кристаллизоваться в одних и тех же кристаллических системах и образовывать вместе смешанные кристаллы.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Часть I
1. Электроотрицательность (ЭО) - это способность атомов оттягивать к себе электронные пары.
Все, с чем мы столкнулись, связано с отдельными атомами. Но атомы связываются, другими словами, они держатся друг с другом. Потому что, если бы атомы не держались вместе, мы все были бы просто набором атомов, и не было бы причин делать это видео. Таким образом, атомы соединяются вместе и образуют молекулы. Вы кладете кучу атомов вместе, они связываются друг с другом и создают молекулы. Затем эти молекулы связываются друг с другом, и вы получаете больше структур. Если бы мы говорили об органической химии, у вас было бы куча атомов, много углерода и водорода и другие вещи, связанные друг с другом, и это создавало бы белки.
3. Если ковалентная химическая связь образуется между атомами разных элементов-неметаллов, то общие электронные пары смещены в сторону более электроотрицательного элемента. На нём возникает избыточный отрицательный заряд, а на атоме-партнёре - избыточный положительный заряд. Такая связь называется ковалентной полярной.
Итак, все начинается, атомы связаны друг с другом. Соответственно объединяйтесь, и цель этого видео - немного подумать о том, как атомы соединяются друг с другом. И тогда у вас есть еще один атом, который действительно хочет взять электрон. Они все хотят быть похожими на драгоценные газы, все зависят драгоценным газом. Поскольку у редких газов имеется 8 электронов в их внешнем слое. Итак, эти металлы хотят избавиться от электрона и кто хочет взять электрон? Галоген, мы уже говорили об этом. Эти элементы обожают прием электронов.
Они не единственные, но у них отличная электроотрицательность. Они действительно хотят взять электрон. Итак, когда вы ставите их близко к вам, что происходит? И скажем, мы хотим немного еды, поэтому у вас есть натрий и хлор. Валентный слой натрия выглядит так. Там есть электрон, от которого он хочет избавиться. И, конечно, это не похоже на одного. Есть миллиарды этих атомов, блуждающих вокруг. И электроны прыгают назад и вперед от одного атома к другому. Но для нашего случая давайте просто упростим эти два атома.


5. Дополните таблицу «Ковалентная полярная связь».

Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.
И если этот натрий-электрон отскакивает, что происходит с натрием? Натрий тогда не имеет электрона в его валентной сфере. Хотя на самом деле он имеет свой валентный слой, теперь слой ниже. Но мы можем сказать, что он потерял электрон, а его электронная конфигурация такая же, как у неона. Но теперь у него есть электроны немного меньше, чем у его протонов. Раньше он был нейтральным, но теперь его положительно обвиняют. Он счастлив теперь, потому что он больше похож на аргон. Он имеет полностью заполненный валентный слой.
Теперь вместо этого есть 18 электронов. Так что же это за заряд? 17 протонов, 18 электронов, т.е. заряда. Теперь оба атома довольны своей электронной конфигурацией. Оба имеют устойчивые валентные слои. Но теперь их привлекают кулоновские силы. Позитивный привлекает негатив, негатив притягивается к положительному. И эти силы могут быть очень сильными, поэтому оба атома склеиваются. И потому, что этот атом так сильно хочет электрона, и этот хочет его так много, они просто передают его. И так производится соль.

2. Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла:
страз.
1) HF С
3) FeBr3 Т
5) SO2 Р
7) CO2 А
9) PCl5 З
3. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета. Сделайте вывод:
С увеличением порядкового номера ЭО растёт.
4. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицатель¬ности найдите с помощью Интернета.
В группе с увеличением порядкового номера ЭО уменьшается.
5. Наиболее полярной является химическая связь в молекуле:
4) фтороводорода - HF
6. Расположите следующие вещества в порядке уменьшения полярности химической связи.
4) фосфид калия - К3Р
2) фосфид алюминия - АlР
3) хлорид фосфора (V) - РСl5
1) белый фосфор - Р4

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter