Как выяснить качественный и количественный состав вещества
Важнейшей характеристикой вещества является его состав: качественный и количественный. Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого элемента в составе мельчайшей частицы вещества – его молекулы.
Одним из основных законов химии является закон постоянства состава , который утверждает, что многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав .
§2. Химическая формула
В приборе для электролиза воды пропустим через воду электрический ток.
Под его действием молекулы воды разрушаются. Продукты протекающей химической реакции – два бесцветных газообразных вещества собираются в трубках прибора. Трубки прибора градуированы, и это позволяет определить, что объёмы газов относятся как 2:1. Если поднести тлеющую лучинку к трубке, содержащей меньший объём газа, и открыть кран, то лучинка ярко вспыхнет: один из неизвестных газов оказывается кислородом. При проверке другого газа горящей лучинкой раздается негромкий хлопок. Так сгорает водород. Следовательно, при разложении воды электрическим током образовались два газообразных вещества: водород и кислород, объемные отношения которых выражаются как 2:1.
Известно, что 1 литр водорода имеет массу, равную 0,089 г, а 1 литр кислорода – 1,429 г. Найдем соотношение масс образовавшихся в проведенном опыте веществ и получим соотношение 2:16. Известно, что масса атома кислорода равна 16, а масса атома водорода – 1. Следовательно, в молекуле воды на два атома водорода приходится один атом кислорода.
Эти расчеты подтверждают закон постоянства качественного и количественного состава вещества.
 Если мы захотим описать качественный и количественный состав молекулы воды, то нам нужно сделать такую запись: 2 атома водорода, 1 атом кислорода
. Эта запись не слишком удобна, ее лучше сделать при помощи химических знаков Н и О. Число атомов покажем при помощи индексов – чисел, которые записываются справа и снизу от химического знака, при этом число 1 не пишем. У нас получилась такая запись – Н 2 О. Данная запись и есть химическая формула.
Если мы захотим описать качественный и количественный состав молекулы воды, то нам нужно сделать такую запись: 2 атома водорода, 1 атом кислорода
. Эта запись не слишком удобна, ее лучше сделать при помощи химических знаков Н и О. Число атомов покажем при помощи индексов – чисел, которые записываются справа и снизу от химического знака, при этом число 1 не пишем. У нас получилась такая запись – Н 2 О. Данная запись и есть химическая формула.
Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
При прочтении химической формулы произносится обозначение и индексы.
Например, формула серной кислоты читается как H 2 SO 4 и обозначает, что молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Формула углекислого газа – CO 2 , обозначает, что его молекула состоит из одного атома углерода и двух атомов кислорода.
Формула хлорида натрия NaCl читается так: натрий хлор. Хлорид натрия – это вещество немолекулярного строения и в нем на один атом натрия приходится один атом хлора.
§3. Описание качественного и количественного состава вещества при помощи химических формул
Чтобы получить вещество, которое называется сульфид железа, нужно смешать железо и серу в массовых отношениях 7:4. Если порошки железа и серы смешать в других массовых соотношениях, например 10 г железа смешать с 4 г серы, то реакция произойдет, но 3 г железа в реакцию не вступят.
Зная массы атомов железа (56) и серы (32), можно найти отношения чисел атомов этих элементов в сульфиде железа.
Для расчетов можно воспользоваться пропорцией: 7 массовых частей железа соединяются с 4 массовыми частями серы, а 56 массовых частей железа – с неизвестным числом массовых частей серы. 56 умножаем на 4 и делим результат на 7, получаем 32. Так как масса атома железа равна 56, а масса атома серы – 32, то в сульфиде железа на один атом железа приходится один атом серы.

Следовательно, химическая формула будет следующей – FeS .
Запись СО 2 имеет сразу два смысла: вещество углекислый газ и одна молекула углекислого газа. Иногда требуется сделать запись, обозначающую другое число молекул, тогда используют коэффициенты.
Коэффициент – это число, которое записывается перед формулой и обозначающее количество молекул, отдельных атомов или других частиц. Коэффициент 1, как и индекс 1, не записывается.
Например, запись 5 H 2 O обозначает пять молекул воды. Если нужно сделать выводы об общем количестве атомов, необходимо помнить, что коэффициент относится ко всей молекуле и в пяти молекулах воды содержится 10 атомов водорода и 5 атомов кислорода.
Запись 10 Cu обозначает 10 отдельных атомов меди, а запись 7 O 2 – 7 молекул простого вещества кислорода, содержащих 14 атомов кислорода.
Таким образом, качественный и количественный состав веществ можно описать при помощи химических формул посредством химических знаков и индексов. Число молекул, отдельных атомов или других частиц можно указать при помощи коэффициентов.
Литература:
Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Для визуального оформления использовались источники:
Рассмотрим качественный и количественный состав веществ. Определим его особенности для соединений органического и неорганического происхождения.
Что показывает качественный состав вещества
Он демонстрирует виды атомов, которые есть в анализируемой молекуле. К примеру, вода образована водородом и кислородом.
Молекула включает в себя атомы натрия и кислорода. В серной кислоте содержатся водород, кислород, сера.

Что показывает состав количественный
Он демонстрирует количественное содержание каждого элемента внутри сложного вещества.
К примеру, в воде находится два атома водорода и один кислорода. Серная кислота состоит из двух водородов, одного атома серы, четырех кислородов.
В составе три атома водорода, один фосфор, четыре атома кислорода.
Качественный и количественный состав веществ есть и у органических веществ. Например, метан содержит один углерод и четыре водорода.

Способы определения состава вещества
Качественный и количественный состав веществ можно определить химическим путем. К примеру, при разложении молекулы сложного соединения образуется несколько молекул с более простым составом. Так, при нагревании карбоната кальция, состоящего из кальция, углерода, четырех атомов кислорода, можно получить два и углерода.
И образующиеся в ход химического разложения соединения могут иметь различный качественный и количественный состав веществ.
Простые и сложные соединения могут быть молекулярного, а также немолекулярного состава.
Первая группа находится в разных агрегатных состояниях. Например, сахар является твердым веществом, вода - жидкая, кислород - газ.
Соединения немолекулярного строения при стандартных условиях находятся в твердом виде. К ним относятся соли. В процессе нагревания они плавятся, переходят из твердого вида в жидкое состояние.

Примеры определения состава
«Опишите качественный и количественный состав следующих веществ: оксида серы (4), оксида серы (6)». Такое задание является типовым в школьном курсе неорганической химии. Для того чтобы справиться с ним, сначала нужно составить формулы предложенных соединений, пользуясь валентностями либо степенями окисления.
В обоих предложенных оксидах присутствуют одни и те же химические элементы, следовательно, их качественный состав одинаковый. Они включают в себя атомы серы и кислорода. А вот в количественном соотношении результаты будут отличаться.
В первом соединении содержится два атома кислорода, а во втором их шесть.
Выполним следующее задание: «Опишите качественный и количественный состав веществ H2S».
Молекула сероводорода состоит из атома серы и двух водородов. Качественный и количественный состав вещества H2S позволяет предугадывать его химические свойства. Так как в составе присутствует катион водорода, сероводород способен проявлять окислительные свойства. Например, подобные характеристики проявляются во взаимодействии с активным металлом.
Информация о качественном и количественном составе вещества актуальна и для органических соединений. Например, зная количественное содержание компонентов в молекуле углеводорода, можно определить его принадлежность к определенному классу веществ.
Такая информация позволяет предугадывать химические и физические характеристики анализируемого углеводорода, выявлять его специфические свойства.
Например, зная, что в составе есть четыре атома углерода и десять водородов, можно сделать вывод о принадлежности данного вещества к классу предельных (насыщенных) углеводородов, имеющих общую формулу СпН2п+2. Для всех представителей данного гомологического ряда характерны по радикальному механизму, а также окисление кислородом воздуха.
Заключение
Любое неорганическое и органическое вещество имеет определенный количественный и качественный состав. Информация необходима для установления физических и химических свойств анализируемого неорганического соединения, а для органических веществ состав позволяет устанавливать принадлежность к классу, выявлять характерные и специфические химические свойства.
Й. Я. Берцелиус предложил обозначать химические элементы первой буквой их латинских названий. Так, символом кислорода стала первая буква его латинского названия: кислород - О (читается «о», так как латинское название этого элемента oxygenium). Соответственно, водород получил символ - Н (читается «аш», так как латинское название этого элемента hydrogenium), углерод - С (читается «цэ», так как латинское название этого элемента carboneum). Но латинские названия хрома (chromium), хлора (chlorum) и меди (cuprum), так же как и углерода, начинаются на букву «С». Как же быть? Й. Я. Берцелиус предложил гениальное решение: такие символы записывать не одной, а двумя буквами - первой и одной из последующих букв, чаще всего второй. Так, хром обозначается Сr (читается «хром»), хлор - С1 (читается «хлор»), медь - Сu (читается «купрум»).
Русские и латинские названия, знаки наиболее употребляемых в школе двадцати химических элементов и их произношение приведены в таблице 2.
Таблица 2
Названия и символы некоторых химических элементов
В нашей таблице уместилось всего 20 элементов. Чтобы увидеть все 110 известных на сегодняшний день элементов, нужно обратиться к таблице химических элементов Д. И. Менделеева.
Чаще всего в состав веществ входят атомы нескольких химических элементов. Изобразить мельчайшую частицу вещества, например молекулу, можно с помощью моделей-шариков так, как вы это делали на предыдущем уроке. На рисунке 40 изображены объемные модели молекул воды (а), углекислого газа (б), метана (в) и сернистого газа (г).

Рис. 40.
Объемные модели молекул:
а - воды; б - углекислого газа; в - метана; г - сернистого газа
С помощью символов химических элементов и индексов записываются химические формулы веществ. Индекс показывает, сколько атомов данного элемента входит в состав молекулы вещества. Он записывается справа внизу от знака химического элемента. Например, формулы веществ, изображенных на рисунке 40, записывают так: а - Н 2 O; б - СO 2 ; в - СН 4 ; г - SO 2 .
Химическая формула - основная знаковая модель в нашей науке. Она несет очень важную информацию. Химическая формула показывает:
качественный состав вещества, т. е. атомы каких элементов входят в состав данного вещества;
количественный состав , т. е. сколько атомов каждого элемента входит в состав молекулы вещества.
По формуле вещества можно определить также, является оно простым или сложным.
Например, водород Н 2 , железо Fe, кислород O 2 - простые вещества, а вода Н 2 O, углекислый газ СO 2 и серная кислота H 2 SO 4 - сложные.
Вопросы и задания
- Знаки каких химических элементов содержат заглавную букву С? Запишите их и произнесите.
- Из таблицы 2 выпишите отдельно знаки элементов-металлов и знаки элементов-неметаллов. Произнесите их названия.
- Что такое химическая формула? Напишите формулы следующих веществ:
- а) серной кислоты, если известно, что в состав ее молекулы входят два атома водорода, один атом серы и четыре атома кислорода;
- б) сероводорода, молекула которого состоит из двух атомов водорода и одного атома серы;
- в) сернистого газа, молекула которого содержит один атом серы и два атома кислорода.
Что объединяет все эти вещества?
- Изготовьте из пластилина объемные модели молекул следующих веществ:
- а) аммиака, молекула которого содержит один атом азота и три атома водорода, расположив атомы водорода по отношению к атому азота под углом 110°;
- б) хлороводорода, молекула которого состоит из одного атома водорода и одного атома хлора;
- в) хлора, молекула которого состоит из двух атомов хлора.
Напишите формулы этих веществ и прочитайте их.
- На рисунке 40 изображены модели молекул четырех химических веществ. Сколько химических элементов образуют эти вещества? Назовите их, запишите символы этих элементов и произнесите их.
- Возьмите пластилин четырех цветов. Скатайте самые маленькие шарики белого цвета - это модели атомов водорода, красные шарики побольше - модели атомов кислорода, черные шарики - модели атомов углерода и, наконец, самые большие шарики желтого цвета - в качестве моделей атомов серы. Изготовьте объемные модели молекул, изображенных на рисунке 40.
Качественный (присутствуют визуальные сигналы)
1. элементный состав (устанавливает элементы которые там находятся)
NaCL, Na2CO3, Na2SO4
2. функциональный анализ
3. ионный (устанавливает какие ионы содержатся в вещ-ве)
SO4²¯, SO3²¯,S²¯.
4. молекулярный (Какая молекула содержится)
СН3ОН, С2Н5ОН.
5. Определение изомеров
Количественный (основан на взвешивании продуктов реакции)
1. определение макроэлементов(то вещество, которого много содержится)
2. определение микроэлементов (определ. Содержания вещ-ва от 0.1 до 0.001)
3.определение следовых содержаний(от миллионный долей % и менее)
Структурный
Определяет кристаллические структуры
16. Аналитическая реакция. Аналитический сигнал. Дробный и систематический анализ.
Химические реакции, используемые для целей качественного или количественного анализа называются аналитическими.
Аналитическая реакция приводит к резкому изменению свойств анализируемого объекта, которое легко обнаруживается.
Аналитический сигнал – это внешний эффект аналитических реакций.
Аналитический реагент – это реактив, под действием которого обнаруживаемый компонент вступает в аналитическую реакцию
Если результат ожидаемый совпадает с наблюдаемым, то компонент есть.
Выделяют виды аналит. Сигналов:
Выпадение осадка(физич свойства: цвет, форма и размер кристаллов; хим. Св-ва: взаимодействие с реагентами)
Пример: ионы серебра, при их обнаружении наблюдают осадок бел цвета, и он раствор. В гидроксиде аммония
Изменение цвета. (Обнаруж. Ионов хрома III наблюдают измен. Цвета с зеленого на желтый)
Выделение газа. Обнаруж по выделению пузырьков или по запаху
Примеры: обнаруж карбонат ионов – выделение углекис. Газ. При обнаруж сульфид-ионов- запах сероводорода.
Аналитические реакции делятся:
Групповые (1 реактив одиноково взаимод с неск ионов)
Избирательные (1 реакт. С небольш. Числом ионов)
Специфические или селективные (взаимод только 1 вещ-во)
Различают дробный и систематический анализ.
Дробный. В нем обнаруж. Каждого иона осущ в отдельных порциях исходного анализ раствора ппри помощи спецефич реакций.
Применяют если состав анализир. Пробы прост (3-5 ионов) и надо выяснить есть там тот или иной ион.
Систематический. При помощи групповых реактивов ионы разделяют на аналит группы. При необх. Проводят внутригрупповое разделение.с полученными раствор проводят реакции на каждый обнаруж ион.
Есть 6 групп. В каждой гр проводят неск реакций.
17. Метод микрокристаллоскопии. Определение катионов цинка, калия, натрия.
Микрокристаллоскопия - метод кач. Микрохимич. анализа, основанный на образовании характерных кристаллич. осадков при действии небольших кол-в реактивов на каплю анализ. раствора на предметном стекле. Осадок исследуют под микроскопом о его составе судят по форме кристаллов, а также по их цвету и размеру. Образующ. кристаллы приобретают характерную форму в разбавленных растворах. При высоких концентрациях осаждаемых веществ, а также при наличии посторонних соединений возможно искажение формы кристаллов.. Микрокристаллоскопию применяют обычно для анализа очень небольших объектов (растительных клеток, включений в металлах, минералах и так далее).
|
критерии |
действия |
результат |
|
|
1.Ртутно-радановый реактив СН3ООН/ HСL |
Добавляем реактив |
Бел. Кристалл. осадок |
|
|
На предмет стекло к анализ. Р-ру+ реактив +СН3ООН/HСL |
В укс.к-те крист. В виде крестов и дендридов. В солян к-те-треугольники и клинья |
||
|
Смесь ацетата цинка и ацетата уранила |
Анализ. Р-р+ реактив |
Бледно – желтый кристалич. осадок. |
|
|
На предмет. Стекле- крист в виде тетраэдров и октаэдров. |
|||
|
Заряд + (обнаруж. Калия проводится после обнар. аммония.) |
1. гексанитрокобальтиат |
Анализ.р-р+реактив |
Желт. Кристалич. осадок. |
|
2.смесь нитритов |
Черн. Крист.осадок черн. Крист. В виде квадратов и прямоуг. |
18.Свинец, серебро, алюминий в объектах судебных исследований. Идентификация
|
В виде металла |
В виде соединения |
||
|
Изг. Пулей, автомоб. аккумуляторы, емкости для переноса радиоактив. В-в. печатные клише в типограф. |
Пигмент красок(бел., красн-корич., желт), детонатор взрыв в-в.,коспонент автомоб. Аккум.яды замед действ.(соли свинца). фальсификация бензина. |
||
|
Ювелир.изд., дет. д/электротехники,катод в батарейках, обеззараж. Воды,отраж.поверхн. зеркал. |
Фотопластинки, фотоленты,детонатор |
||
|
Аллюминий |
Провода, посуда, баночки д/пива,фольга, радиаторы, корпуса самолетов, двигатель авто,ювелир. Сплавы(фальсифик. Серебра) |
Драг.камни:рубин(красн),сапфир(син), сорбент(поглотитель) |
|
результат |
||
|
1.р-р хромата натрия |
Образ. Желт.крист. осадок. Котор. раствор в щелочи. |
|
|
2.р-р йодида калия |
Образ.желт.крист.осадок, котор раствор в избытке йодида калия |
|
|
Бел.крист.осадок к нему +2й реагент и осадок растворится Затем провер. Реакции при помощи азот к-ты или иодидом калия |
||
|
алюминий |
Ализарин s+ р-р аммиака |
Если алюмин. Нет – р-р фиолет, если есть то красный. |
19. Железо, медь, ртуть в объектах судебных исследований. Идентификация
|
В виде металла |
В виде соединения |
||
|
Кузов авто,мосты,железобет.строения, Оружие,пули,снаряды, посуда, трубы,для электродвиг. И тд. |
В сост крови, лекарства,краситель чернил,ржавчина, |
||
|
Градусник,термометр | |||
|
Чист.металл:провода,оюмотка электродвиг,тормозн.сист.авто,газовые линии,монеты,кресты,предметы быта. Сплавы: ювелир.золото(чист зол + медь) никель+медь-монеты, посуда, латунь(медь+цинк) гильзы,дет авто, гайки,болты,краны водопров. штекеры,вилки,розетки и тд. Бронза(медь + олово)монеты,статуэтки, оружие и др, дюралюминий (медь+алюминий) трубы,корпуса,детали машин. |
Антисептик, пестицид, удобрение (медн.купорос), малахит. Ювелир украш. Зеленые краски. |
20. Кальций, никель, аммоний в объектах судебных исследований. Идентификация
|
В виде металла |
В виде соединения |
||
|
Не исп. Тк сразу окисляется |
Мел,известняк,накипь,бел.кирпич,скорлупа яич.,жемчуг,гипс,фосфорная мука,кости,негашеная и гашеная известь. |
||
|
Основа большинства сплавов – жаропрочных материалов,применяемых в аэрокосмической промыш для деталей силовых установок. 1) с железом и хромом – нержавейка(посуда,трубы) 2) никель+золото+серебро = белое золото 3) нихром=никель+хром для нитей накала в электронагревательной технике 4) для монет 5) для никелирования в целях защиты от коррозии 6) радиоактивный изотоп 63Ni – источник бета-излуч |
(редко, почти не встречается) |
||
|
В виде солей,котор помогают разлагаться живым сущ. Р-р аммиака в воде NH4OH 2)нашатырный спирт – р-р хлорида аммония в спирте NH4Cl 3)аммиачная селитра NH4NO3 – удобрение и компонент взрыв.в-в 4) фосфат аммония и гидрофосфаты аммония - удобрения |
21. Идентификация нитратов и сульфатов в объектах судебных исследований.
Сульфат-ион – SO4 z 2-
Реагентом является растворимая соль бария (хлорид бария, нитрат бария)
При приливании реагента к анализируемому вещ-ву образуется белый кристаллический осадок, которые не растворяется в кислотах и щелочах.
Но для того что бы убедиться нужно провести проверочную реакцию, прилив кислоту к осадку, но не использ. Серную кислоту.
Нитрат-ион – NO3 ¯
Для того что бы обнружить ионы нитрата используется реакция бурого кольца.
Для этого к анализ р-ру приливают раствор сульфата железа II , к этой смеси осторожно приливаем концентрир. Серную к-ту, не смешивая 2 жидкости, на границе этих 2х жидкостей происходит окрашивание в коричневый цвет, это и будет бурое кольцо.
22. Идентификация карбонатов и хлоридов в объектах судебных исследований.
На каждый анион существует специфическая реакция, поэтому анализ смеси этих анионов производится дробным методом, т.е. к 1-2 каплям анализ. Р-ра приливают реагент и наблюдают аналитический сигнал, по которому определяют наличие анионов в анализ. В-ве.
Для обнаружения хлорид ионов CL¯ реагентом является нитрат серебра с добавлением азотной к-ты. В результате выпадает белый осадок, нужно выполнить проверку, к осадку прилить р-р аммиака затем прилить азотною к-ту, наблюдаем повторное выпадение осмадка или помутнение р-ра.
Карбонат-ионы.CO3 z 2-.
Реагентом явл. Р-р сильной к-ты. (серная, азотная,соляная)
При приливании к анализ. В-ву неск. капель к-ты в р-ре наблюдается выделение пузырьков газа. При этом пробирку можно нагреть в руках.
23. Титрование. Точка эквивалентности.
Титриметрический метод анализаь – это метод количественного анализа основанный на измерении объема раствора реагента известной концентрации необходимого для взаимодействия с определяемым веществом.
Титриметрия – один из классических и наиб. Распр. Методов аналит.химии, который не утратил свое значение не смотря на то, что уделяется внимание новым методам. По положительным свойствам титриметрия занимает 1 из первых мест среди многочислен. Методов колич. Анализа.(простота аппаратуры и операций, высокая точность определения)
Процесс титрирования заключается в том, что к определяемому объему анализ. Р-ра, приливают титрант(р-р которым титрируют). Титрирование продолжается до тех пор, пока кол-во прибавленного реагента не станет эквивалентным кол-ву определ. Вещества.
Точка эквивалентности – это момент при котором кол-во прибавленного реагента становится эквивалентным кол-ву определ. В-ва. Момен эквивалентности можно установить разными способами,напр. Изменением окраски индикатора.
24. Метод нейтрализации. Индикаторы в аналитич. химии.
Титриметрическим методом анализа называют метод количественного анализа, основанный на измерении объема реагента известной концентрации, необходимого для взаимодействия с определяемым веществом.
Берем титрант (это раствор известной нам концентрации) , добавляем небольшими порциями в раствор неизвестной концентрации и, когда прошла нейтрализация, индикатор окрашивается в другой цвет и сравнивая объемы находим концентрации.
Прямое титрование - это когда титруем определяемое вещество. Например, титруем кислоту щелочью, записываем объем, находим концентрацию.
ОБратное титрование - это если например кислоты в пробе немерено, то добавляем сразу на глаз немерено щелочи (замеряем, естественно, сколько) и оттитровываем оставшуюся щелочь кислотой. По разнице находим исходную концентрацию кислоты.
Основное уравнение титриметрии: С(fэкв стандарта) *Vст = С (fэкв Х) *Vx
С(fэкв стандарта)- нормальная концентрация стандартного раствора (р-р реагента известной концентрации), моль/л
С (fэкв Х) –норм концентрация определяемого в-ва в анализируемом р-ре, моль/л
fэкв – фактор эквивалентности
Vст- объем стандарт.р-ра, необх для завершения реакции с определяемым в-вом, л
Vх – объем анализируемого р-ра, взятого для титрования, л (точно измеренный размер - аликвота)
Основные индикаторы: - метилоранж(интервал изменения окраски при рН 3,1-4,4)
Фенолфталеин (рН 8,0-9,8)
25. Метод комплексонометрии. Установление происхождения воды по солевому составу.
Комплексонометрия (трилонометрия) - титриметрический метод, основанный на реакциях образования комплексных соединений ионов металлов с органическими реагентами (комплексонами). При этом образуются очень прочные, хорошо растворимые в воде комплексонаты. Метод отличаетсы быстротой и высокой точностью. Метод позволяет определять практически все катионы и многие анионы. В качестве титрантов используют производные полиаминокарбоновых кислот (например: трилон Б).
Установление происхождения воды по солевому составу: в колбу для титрования добавляем 10мл исследуемой воды, пару капель HCl и нагреваем. После охлаждения к исследуемому р-ру добавляем 5 мл аммиачного буферного р-ра и немного хромагена, р-р окрасился в розовый цвет. Затем четыре раза титруем р-р до изменения окраски на сине-зеленый с помощью трилона Б. выясняем содержание солей, смотрим по таблице, оп и все, вы великолепны! Формула общ жесткости: * 10(это типа степень)
Сапонинов в лекарственном сырье.
1.1 Определение сапонинов.
1.2 Классификация.
1.3 Качественное и количественное определение.
Анализ эфирного масла.
2.2 Определение эфирных масел
2.3 Анализ.
Качественное и количественное определение антраценпроизводных в лекарственном растительном сырье
Понятие антраценпроизводных и их свойства
Качественный анализ антрогликозидов
Количественное определение антрогликозидов
Качественное и количественное определение дубильных веществ в лекарственном растительном сырье.
Понятие о дубильных веществах и классификация
Качественный анализ дубильных веществ
Количественный анализ дубильных веществ
Качественное и количественное определение алкалоидов в лекарственном растительном сырье.
Понятие об алкалоидах и классификация
Качественное определение
Количественное определение суммы гликозидов
Список используемой литературы
Качественный анализ сапонинов в лекарственном растительном сырье.
Для качественного анализа готовят водный настой 1:10, нагревая измельченное сырье с дистиллированной водой на водяной бане 10 минут. После охлаждения фильтруют. С фильтратом проводят качественные реакции.
1) К 2 мл водного настоя в пробирке прибавляют несколько капель раствора ацетата свинца. Образуется осадок. Причем тритерпеновые сапонины осаждаются средним ацетатом свинца, а стероидные – основным.
2) Реакция Либермана – Бурхардта (на стероидное кольцо). Для проведения этой реакции испытываемое вещество растворяют в ледяной уксусной кислоте и добавляют смесь уксусного андидрида и концентрированной серной кислоты (50:1).
Через некоторое время развивается окраска от розовой до синей.
3) Реакция на пенообразование. Берут две пробирки, в одну приливают 5 мл 0,1 н раствора HCL , а в другую – 5 мл 0,1 н раствора. Затем в обе пробирки добавляют по 2 – 3 капли извлечения или раствора сапонинов в обеих пробирках образуется пена, равная по объему стойкости. Если содержатся сапонины стероидной группы (щелочная среда) – образуется более стойкая и мощная пена.
Количественное определение сапонинов.
К 0,4 – 2,0 г. Крупного порошка испытуемого сырья добавляют 0,9 г хлористого натрия. Заливается 100 мл кипящей дистиллированной воды, взвешивается. Настаивается 15 минут на кипящей водяной бане, охлаждается. Затем колбу доводят до первоначального веса добавлением воды и фильтруют. В 10 пробирок градуированной пипеткой отмеряют испытуемый раствор в количествах, отраженных в таблице и доводят до объема, 0,9%- ым раствором хлорида натрия:
Анализ Эфирного масла.
2.1 Определение эфирных масел. Эфирные масла - прозрачные, бесцветные или слегка окрашенные (желтые, зеленые, коричневые, красноватые) жидкости, имеющие выраженный характерный аромат. Эфирные масла - маслянистые на вид жидкости, по своему химическому составу не относятся к классу жиров (масел). В состав эфирны х масел входят следующие группы химических соединений: терпены, спирты, кетоны, альдегиды, эфиры, фенолы.
2.2 Анализ Эфирного масла. При исследовании эфирного масла определяют его подлинность, отсутствие примеси и числовые показатели – плотность, угол вращения, кислотное число и после ацетилирования.
Подлинность испытуемого масла устанавливают, определяя цвет, запах и вкус масла.
Цвет /прозрачность устанавливают поместив 10 мл масла в цилиндр из прозрачного бесцветного стекла диаметром 2-3 см, наблюдая в проходящем цвете.
Запах определяют следующим образом: 0,1 мл (2 капли) масла наносят на полоску фильтровой бумаги длинной около 12 см и шириной 5 см так, чтобы масло не смачивало края бумаги и сравнивают запах испытуемого образца через каждые 15 минут с запахом контрольного образца, нанесенного таким же образом на фильтровальную бумагу. В течение одного часа запах должен быть одинаков с запахом контрольного образаца.
Вкус устанавливают, прикладывая к языку полоску фильтровальной бумаги с нанесенной на нее каплей масла или крупинку смеси 1 г сахарной пудры с одной каплей испытуемого масла.
Определение примесей :
А) Спирт этиловый. Несколько капель испытуемого масла наносят на воду налитую на часовое стекло и наблюдают на черном фоне; не должно быть заметного помутнения вокруг капли масла.
Б) Жирные и минеральные масла. 1 мл эфирного масла взбалтывают в пробке с 10 мл 90%- го этилового спирта; не должно появляться мути и жирных капель.
Числовые показатели:
А) Показатель преломления определяют в рефрактометре. Показатели преломления – отношение скорости распространения света в воздухе и скорости распространения света в испытуемом веществе. Показатель преломления зависит от природы вещества, температуры и длины волны света. Методика описана в ГФ Х с. 776.
Б) Кислотное число – это количество миллиграммов KOH, необходимое для нейтрализации свободных кислот в 1 г исследуемого в –ва. Обычно, количество кислот в эфирном масле незначительно, но при длительном хранении в результате окислительных процессов кол-во кислот увеличивается. Методика определения кислотного числа: пробу эфирного масла 0,2 -0,5 г, взятую с точностью до 0,01 г, растворяют в 5 мл 95% этилового спирта, предварительно нейтрализованного по фенолфталеину 0,1 н NaOH (если нужно, нагревают с обратным холодильником на водяной бане до полного растворения). Прибавляют 0,5 мл фенолфталеина и титруют при постоянном перемешивании 0,1 н NaOH до появления розового окрашивания, не исчезающего в течение 30 сек. 1 мл 0,1 н NaOH соответствует 5,61 мг KOH. Кислотное число вычисляют по формуле: , где V - объем 0,1 н NaOH, израсходованной на титрование, мл. m – маса навески эфирного масла, г.
Классификация.
Существует несколько классификаций дубильных веществ. Одна из них, наиболее старая, но не потерявшая своего значения и в настоящее время, основана на способности дубильных веществ разлагаться при нагревании.
Качественное определение.
1) 1, 0 крупного порошка растительного сырья залить 100 мл кипящей воды и настаивать на водяной бане (кипящей) в течение 15 минут, затем профильтровать не охлаждая через бумажный фильтр.
2) К 2-3 мл фильтрата прибавить 3 – 5 капель 1% ого раствора хлорида железа или железоаммонийных квасцов. Образуется черно – синее окрашивание при наличии дубильных веществ гидролизуемой группы или черно – зеленое окрашиваниеь (дубильные вещества конденсированной группы) , переходящие в осадки.
Количественное определение.
Около 2,0 (точная навеска) измельченного сырья, просеянного сквозь сито с диаметром отверстий 3 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником на плитке с закрытой спиралью в течение 30 минут при периодическом помешивании. Жидкость охлаждают до комнатной температуры и процеживают около 100 мл в мерную колбу вместимостью 200 –250 мл через вату так, чтобы частицы сырья не попали в колбу. Затем пипеткой отбирают 25 мл полученного извлечения и переносят в другую колбу вместимостью 750 мл, прибавляют 500 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном помешивании МЕДЛЕННО рпствором перманганата калия (0,-2 моль/л) до золотисто – желтого окрашивания, обусловленного образоанием изатина.
Параллельно проводят контрольный опыт. Берут 25 мл раствора индигосульфокислоты, добавляют 500 мл воды и медленно титруют раствором перманганата калия. (0Ю02 моль/л) до золотисто – желтого окрашивания. 1 мл раствора перманганата калия (0,02 моль /л) соответствует 0, 004157 г дубильных в-в в пересчете на танин. Содержание дубильных вкщкств (Х) в процентах (до второго знака 0,00%) в пересчете на абсолютно сухое сырье вычисляют по формуле: ![]()
Y – объем раствора перманганата калия, израсходованного на титрование извлечения, в мл.
Объем раствора перманганата калия, израсходованного на титрование в контрольном опыте, в мл
0,004157 – количество дубильных веществ, соответствующее 1 мл раствора перманганата калия (0,02 моль/л) в пересчете на танин, в граммах, а – масса сырья в граммах
В – потеря в массе при высушивании сырья в %(влажность)
250 – объем извлечения в мл
25 – объем извлечения, взятого для титрования в мл.
Результаты расчетов сравнить с требованиями ГФ и записать вывод: соответствует/не соответствует исследуемое сырье требованиями ГФ ХI издания.
Классификация
1. Алкалоиды с азотом в боковой цепи - эфедрин из различных видов эфедры, сферофизин из травы сферофизы солонцовой, колхицин и колхамин из клубнелуковиц безвременников.
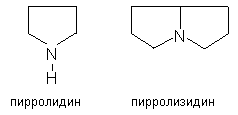
2. Производные пирролидина и пирролизидина (платифиллин, саррацин, сенецифилллин из крестовника плосколистного и ромболистного).
3. Производные пиридина и пиперидина (анабазин, лобелин) из анабазиса безлистного и лобелии одутлой.

4. Алкалоиды с конденсированными пирролидиновыми и пиперидиновыми кольцами (производные тропана) - гиосциамин, атропин, скополамин из красавки, белены, дурмана.

5. Производные хинолизидина (пахикарпин, термопсин) - софора толстоплодная, термопсис.

6. Производные хинолина - хинин из хинной коры, эхинопсин из плодов мордовника.
7. Производные изохинолина - сальсолин из солянки Рихтера, морфин и папаверин из коробочек мака, алкалоиды чистотела, барбариса, мачка желтого.

8. Производные индола - алкалоиды спорыньи, барвинков, резерпин из корня раувольфии, стрихнин из семян чилибухи, катарантус розовый.

9. Производные пурина - кофеин из листьев чая и семян колы.
Качественное определение.
1,0 измельченного сырья заливают 25 мл 1% раствора HCl и нагревают в колбе на водяной бане (кипящей) 5 минут. Охлаждают, фильтруют. Фильтрат разливают в пробирки по 1 -2 мл и добавляют по каплям соответствующие реактивы. При наличии алкалоидов сразу или через некоторое время появляется муть или осадок, либо какое –нибудь окрашивание. Интенсивность проявления мути или осадка оценивается от одного до пяти знаков плюса.
Реактивы, осаждающие алкалоиды:
1) 1% раствор кремневольфрамовой кислоты.
2) 1-3% водный раствор фосфорномолибденовой кислоты.
3) 1-3% раствор фосфорновольфрамовой кислоты.
4) Реактив Вагнера (2,0 г К1 и 100 мл воды)
5) Реактив Майера (1,358 г двухлористой ртути в 60 мл воды + (5,0 г иодида калия в 10 мл воды разбавляют до 100 мл водой)
6) Реактив Драгендорфа (нитрат висмута основной, иодид калия, уксусная кислота, вода)
7) 10% раствор пикриновой кислоты
Реактивы, окрашивающие алкалоиды:
1. Серная и азотная кислоты: 10 капель разбавленой азотной кислоты (10 капель 30% азотной кислоты в 100 мл воды) смешивают с 20,0 г концентрированной серной кислоты. Используют смесь по 10 кап. Сильно разбавленной хлористоводородной кислоты и 20 мл конц. серной кислоты. Эти реактивы со многими алкалоидами образуют различное окрашивание: желтое, разные оттенки красного, голубого, фиолетового, зеленого.
2. Ванадин – серная кислота (ванадат аммония, 0,1 г конц. серная кислота 20,0 г. Окрашивает атропин в желто – красный цвет, аконитин – в светло – коричневый цвет, кониин – в зеленый. В рабочей тетради составить таблицу, в которой отметить знаком «плюс» (от одного до пяти) интенсивность образования мути или осадка с водными экстрактами исследуемых видов алкалоидного растительного сырья.
Качественное и количественное определение
- Владимир Иванович Долгих: биография Долгих секретарь цк кпсс
- Глисты у собаки: симптомы, фото, лечение и профилактика
- На что можно потратить материнский капитал?
- Ванильный кекс с кусочками шоколада
- Торт на сковороде за 20 минут
- Свинина с грибами и сыром в духовке: самые удачные рецепты
- Сушеная спаржа быстрого приготовления

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter