Атомная химическая связь. Основные химические связи. Рис.1 Ван-дер-ваальсовы силы
3.3.1 Ковалентная связь – это двухцентровая двухэлектронная связь, образующаяся за счёт перекрывания электронных облаков, несущих неспаренные электроны с антипараллельными спинами. Как правило образуется между атомами одного химического элемента.
Количественно она характеризуется валентностью. Валентность элемента – это его способность образовывать определенное число химических связей за счёт свободных электронов, находящихся атомной валентной зоне.
Атомы образуют химические связи, чтобы сделать их внешние электронные оболочки более устойчивыми. Тип химической связи максимизирует стабильность атомов, образующих его. Другие, кроме ионных и ковалентных химических связей, существуют. В самом первом только два электрона: атом водорода имеет один протон и одинокий электрон, поэтому он может легко делиться своим электроном с внешней оболочкой другого атома. Атом гелия имеет два протона и два электрона. Два электрона заполняют свою внешнюю электронную оболочку, а атом электрически нейтрален таким образом.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. Связь между атомами может осуществляться не только одной, но и двумя и даже тремя поделенными парами. Такие связи называются двойными и тройными - кратными связями.
Это делает гелий устойчивым и вряд ли образует химическую связь. Прошлый водород и гелий легче всего предсказать, будут ли два атома образовывать связи и сколько связей они будут образовывать. Большинство атомов нуждаются в 8 электронах для завершения их внешней оболочки. Таким образом, атом, имеющий 2 внешних электрона, часто образует химическая связь с атомом, которому не хватает двух электронов, чтобы быть «полным».
Например, атом натрия имеет один единственный электрон в своей внешней оболочке. А атом хлора, напротив, представляет собой короткий один электрон, чтобы заполнить его внешнюю оболочку. Натрий легко жертвует свой внешний электрон, в то время как хлор легко принимает донорские электроны.
3.3.1.1 Ковалентная неполярная связь. Связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной. Она возникает между атомами с практически равной электроотрицательностью (0,4 > ΔЭО > 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов у гомоядерных молекул. Например, Н 2 , О 2 , N 2 , Cl 2 и т. д. Дипольный момент таких связей равен нулю. Связь СН в предельных углеводородах (например, в СН 4) считается практически неполярной, т.к. Δ ЭО = 2,5 (С) - 2,1 (Н) = 0,4.
Примечание об электрической зарядке
Натрий и хлор образуют ионную связь друг с другом, образуя поваренную соль или хлорид натрия. Вас может смутить вопрос о том, связана ли стабильность атома с его электрическим зарядом. Атом, который получает или теряет электрон для образования иона, более устойчив, чем а, если ион получает полную электронную оболочку путем образования иона.
Прогнозирование облигаций между атомами
Поскольку противоположные заряженные ионы притягиваются друг к другу, эти атомы будут легко образовывать химические связи друг с другом. Вы можете использовать несколько предсказаний о том, будут ли атомы образовывать связи и какие типы связей они могут образовывать друг с другом. В правой части периодической таблицы находится группа вызываемых элементов. Атомы этих элементов имеют полные внешние электронные оболочки. Эти атомы устойчивы и очень редко образуют связи с другими атомами.
3.3.1.2 Ковалентная полярная связь. Если молекула образована двумя разными атомами, то зона перекрывания электронных облаков (орбиталей) смещается в сторону одного из атомов, и такая связь называется полярной . При такой связи вероятность нахождения электронов возле ядра одного из атомов выше. Например, НCl, H 2 S, PH 3 .
Полярная (несимметричная) ковалентная связь - связь между атомами с различной электроотрицательностью (2 > ΔЭО > 0.4) и несимметричным распределением общей электронной пары. Как правило, она образуется между двумя неметаллами.
Рис.1 Ван-дер-ваальсовы силы
Один из лучших способов предсказать, будут ли атомы связываться друг с другом и какой тип связей они образуют, - это сравнить атомы. Электроотрицательность - это мера притяжения атома к электронам в химической связи. Большая разница между значениями электроотрицательности между атомами указывает на то, что один атом притягивается к электронам, а другой способен принимать электроны.
Эти атомы обычно образуют ионные связи друг с другом. Этот тип связей образуется между атомом металла и атомом неметалла. Если значения электроотрицательности между двумя атомами сравнимы, они могут все еще образовывать химические связи для повышения стабильности их оболочки. Эти атомы обычно образуют ковалентные связи.
Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда (дельта минус), а на менее электроотрицательном атоме - частичного положительного заряда (дельта плюс)
C Cl C O C N O H C Mg .
Вы можете посмотреть, чтобы сравнить их и решить, образует ли атом связь или нет. Электроотрицательность, так что вы можете делать общие прогнозы, не глядя на определенные значения. Электроотрицательность увеличивается, когда вы перемещаетесь слева направо через периодическую таблицу. Он уменьшается при перемещении вниз по столбцу или группе таблицы. Атомы в левой части таблицы легко образуют ионные связи с атомами с правой стороны.
Полярные ковалентные связи
Атомы в середине таблицы часто образуют металлические или ковалентные связи друг с другом. Ионное связывание обычно происходит, когда один атом может легко потерять один или несколько электронов и другой атом, чтобы получить один или несколько электронов. Однако некоторые атомы не будут сдаваться или легко получать электроны. Тем не менее они все еще участвуют в образовании соединений.
Направление смещения электронов обозначается также стрелкой:
CCl, CО, CN, ОН, CMg.
Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения. Поэтому, чем полярнее связь, тем она прочнее.
Существует еще один механизм получения полной валентной оболочки: обмен электронами. Каждый атом Н начинается с одного электрона в его валентной оболочке. Поскольку каждый атом Н имеет заполненную валентную оболочку, эта связь стабильна, и мы создали двухатомную молекулу водорода. Для простоты, это не редкость представлять ковалентную связь с тире, а не с двумя точками.
В качестве другого примера рассмотрим фтор. Мы также можем написать это, используя тире для представления общей электронной пары. В двухатомной молекуле фтора существуют два разных типа электронов. Сцепляющая электронная пара. Пара электронов, образующая ковалентную связь. делает ковалентную связь.
Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. Третьим свойством ковалентной связи является её направленность.
3.3.2 Ионная связь. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому, как правило, ионная связь образуется между металлом и неметаллом.
Ковалентные связи могут быть сделаны между различными элементами. Каждый атом начинает с нечетного числа электронов в его валентной оболочке. Два атома могут делиться своими неспаренными электронами, чтобы сделать ковалентную связь. Два атома могут делиться своим неспаренным электроном.
В ковалентной связи могут участвовать более двух атомов, хотя любая ковалентная связь будет находиться только между двумя атомами. Атомы Н и О могут разделять электрон с образованием ковалентной связи. Н-атом имеет полную валентную оболочку. Однако у атома О есть только семь электронов вокруг него, что не является полным октетом.
Рассмотрим в качестве примера реакцию между атомами натрия (3s 1) и фтора (2s 2 3s 5). Разница электроотрицательности в соединении NaF
ЭО = 4,0 - 0,93 = 3,07
Натрий, отдав фтору свой 3s 1 -электрон, становится ионом Na + и остается с заполненной 2s 2 2p 6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает фтор, приняв один электрон, отданный натрием. В результате возникают силы электро-статического притяжения между противоположно заряженными ионами.
Теперь атом О имеет полный октет вокруг него, и каждый атом Н имеет два электрона, заполняя его валентную оболочку. Существует простой набор шагов для определения электронной точечной диаграммы Льюиса простой молекулы. Во-первых, вы должны идентифицировать центральный атом и окружающие атомы. Центральный атом. Атом в центре молекулы. является атомом в центре молекулы, а окружающие атомы - атомом, который образует ковалентные связи с центральным атомом. - атомы, образующие связи с центральным атомом.
Полярная ковалентная связь
Центральный атом обычно записывают сначала в формуле соединения. После того как идентифицированы центральные и окружающие атомы, выполните следующие шаги. Добавьте дополнительно, если вид имеет отрицательные заряды и удаляет некоторые для каждого положительного заряда на вид. Поместите оставшиеся электроны, если они есть, вокруг центрального атома. Убедитесь, что каждый атом имеет полную валентную оболочку.
- Подсчитайте общее количество валентных электронов.
- Напишите центральный атом и окружайте его окружающими атомами.
- Поместите пару электронов между центральным атомом и каждым окружающим атомом.
- Заполните октеты вокруг окружающих атомов.
Ионная связь – крайний случай полярной ковалентной связи, основанная на электростатическом притяжении ионов. Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов (ЭО > 2), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. В силу этого иoннaя связь не имеет пространственной направленности и насыщаемости , так как каждый ион связан с определенным числом противоионов (координационное число иона). Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Например, MgS, NaCl, А 2 O 3 . Соединений с чисто ионными связями практически не существует, поскольку всегда остаётся некоторая доля ковалентности в силу того, что полного перехода одного электрона к другому атому не наблюдается; в самых «ионных» веществах доля ионности связи не превышает 90 %. Например, в NaF поляризация связи составляет около 80 %.
Напишите центральный атом, окруженный окружающими атомами. Это использует восемь электронов, поэтому у нас осталось 32 - 8 = 24 электрона. Это использует еще 24 электрона, оставляя 24 - 24 = 0 электронов слева. Нет дополнительных электронов, чтобы добавить к центральному атому. Проверьте. Каждый атом имеет полный октет. Иногда, однако, эти шаги не работают. Если бы мы выполнили эти шаги для соединения формальдегида, мы получили бы следующее.
У атомов Н и О есть собственное число электронов, но атом С имеет только шесть электронов вокруг него, а не восемь электронов для октета. Мы фиксируем это, признавая, что два атома могут делиться более чем одной парой электронов. Каждая валентная оболочка заполнена, поэтому это приемлемая электронная точка-точка Льюиса.
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов.
Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления , которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении.
Связь между атомами С и О представляет собой ковалентную связь с двойной связью, состоящую из двух пар связующих электронов. и представляет собой две связанные пары электронов между атомами. Если использование правил для рисования электронных точечных диаграмм Льюиса не работает так, как написано, может потребоваться двойная связь.
Центральный атом является атомом С, причем атомы О являются окружающими атомами. Следуя правилам для электронных диаграмм Льюиса для соединений, мы получаем. О-атомы имеют вокруг них полные октеты, но у атома С всего четыре электрона вокруг него. У каждого атома О еще восемь электронов вокруг него, но теперь атом С также имеет полный октет.
Степень окисления - это условный заряд, который приобретает атом в результате перераспределения электронной плотности. Количественно она характеризуется числом смещённых электронов от менее электроотри-цательного элемента к более электроотрицательному. Положительно заряженный ион образуется из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который эти электроны принял.
Какова правильная электронная диаграмма Льюиса для карбонилсульфида? Хорошими примерами этого являются элементный азот и ацетилен. Многоатомные ионы соединены вместе с ковалентными связями. Однако, поскольку они являются ионами, они участвуют в ионной связи с другими ионами. Таким образом, оба основных типа связи могут возникать одновременно.
Еда и напитки: Витамины и минералы
Витамины являются питательными веществами, которые необходимы нашим организмам в небольших количествах, но не могут синтезироваться; поэтому они должны быть получены из рациона. Слово «витамин» происходит от «жизненного амина», потому что когда-то считалось, что все эти соединения имеют в нем аминовую группу. На самом деле это не так, но имя все равно застряло.
Элемент, находящийся в высшей степени окисления (максимально положительной), уже отдал все свои валентные электроны, находящиеся в АВЗ. А поскольку их количество определяется номером группы, в которой стоит элемент, то высшая степень окисления для большинства элементов и будет равна номеру группы . Что касается низшей степени окисления (максимально отрицательной), то она появляется при формировании восьмиэлектронной оболочки, то есть в том случае, когда АВЗ заполняется полностью. Для неметаллов она рассчитывается по формуле № группы – 8 . Для металлов равна нулю , поскольку они электроны принимать не могут.
Все витамины являются ковалентно связанными молекулами. Большинство из них обычно называют письмом, хотя все они также имеют официальные химические названия. Таким образом, витамин А также называют ретинолом, витамин С называется аскорбиновой кислотой, а витамин Е - токоферолом. Если в диете отсутствует витамин, развиваются такие болезни, как цинга или рахит.
К счастью, все витамины доступны в качестве добавок, поэтому любой диетический дефицит в витамине можно легко исправить. Минералом является любой химический элемент, отличный от углерода, водорода, кислорода или азота, который необходим организму. Минералы, необходимые организму в количестве, включают натрий, калий, магний, кальций, фосфор, серу и хлор. Основные минералы, которые организм нуждается в крошечных количествах, включают марганец, железо, кобальт, никель, медь, цинк, молибден, селен и йод.
Например, АВЗ серы имеет вид: 3s 2 3р 4 . Если атом отдаст все электроны (шесть), то приобретёт высшую степень окисления +6 , равную номеру группы VI , если примет два, необходимые для завершения устойчивой оболочки, то приобретёт низшую степень окисления –2 , равную № группы – 8 = 6 – 8= –2.
3.3.3 Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло– и электропроводность. Эти особенности объясняются существованием в металлах особого вида взаимодействия – металлической связи.
Минералы также получают из рациона. Интересно, что большинство минералов потребляется в ионной форме, а не как элементы или из ковалентных молекул. Как и витамины, большинство минералов доступно в форме таблеток, поэтому любой недостаток можно компенсировать, принимая добавки.
Каждый вход через пантотеновую кислоту представляет собой витамин, и все, от кальция и ниже, является минералом. Для иллюстрации образования ковалентных связей можно привести диаграммы электронов Льюиса. Для правильной иллюстрации сцепления в некоторых молекулах может потребоваться двойная связь или тройные связи между атомами. Сколько электронов будет в валентной оболочке атомов Н, когда оно образует ковалентную связь? Сколько электронов будет в валентной оболочке не-Н атомов, когда они будут ковалентными связями? Обведите вокруг каждого атома электроны, чтобы убедиться, что каждая валентная оболочка заполнена. Ковалентные связи образуются, когда атомы разделяют электроны. . Нарисуйте электронную диаграмму электронов Льюиса для каждого вещества.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов, которые достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы, локализованные в определенных положениях кристаллической решетки, и большое количество делокализованных (свободных) электронов, сравнительно свободно перемещающихся в поле положительных центров и осуществляющих связь между всеми атомами металла за счёт электростатического притяжения.
В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Силы связи в металлах не локализованы и не направлены, а свободные электроны, образующие «электронный газ», обусловливают высокую тепло- и электропроводность. Поэтому в этом случае невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении
3.3.4 Донорно-акцепторная связь. Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый донорно-акцепторный механизм . Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей (неподелённой) электронной пары донора (поставщика электронов) в общее пользование донора и акцептора (поставщика свободной атомной орбитали).
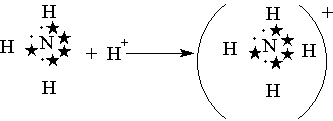
После образования она ничем не отличается от ковалентной. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (рисунок 9) (звездочками обозначены электроны внешнего уровня атома азота):

Рисунок 9- Схема образования иона аммония
Электронная формула АВЗ атома азота 2s 2 2р 3 , то есть он имеет три неспаренных электрона, которые вступают в ковалентную связь с тремя атомами водорода (1s 1), каждый из которых имеет один валентный электрон. При этом образуется молекула аммиака NH 3, в которой сохраняется неподелённая электронная пара азота. Если к этой молекуле подойдёт протон водорода (1s 0), не имеющий электронов, то азот передаст свою пару электронов (донор) на эту атомную орбиталь водорода (акцептор), в результате чего образуется ион аммония. В нём каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н-N, образованные по различным механизмам, никаких различий в свойствах не имеют. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s– и 2р– электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали.
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н + в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н 2 О и иона Н + всегда образуется ион гидроксония Н 3 О + Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H + .
3.3.5 Водородная связь. Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), который «стягивает» на себя общую электронную пару, испытывает недостаток электронов и приобретает эффективный положительный заряд. Поэтому он способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома (который приобретает эффективный отрицательный заряд) этой же (внутримолекулярная связь) или другой молекулы (межмолекулярная связь). В результате возникает водородная связь , которая графически обозначается точками:
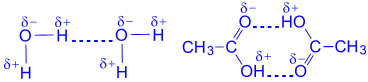
Эта связь значительно слабее других химических связей (энергия ее образования 10– 40 кДж/моль) и в основном имеет частично электростатический, частично донорно-акцепторный характер.
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2 O, H 2 F 2 , NH 3 . Например, связи О-Н в Н 2 О имеют заметный полярный характер с избытком отрицательного заряда – на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд + и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H 2 O) 2 , (Н 2 O) 3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида:
поскольку атом кислорода имеет две неподеленные пары электронов.
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2 Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С. Типичные случаи ассоциации наблюдаются для спиртов и органических кислот.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Н-связи влияют на физические и химические свойства вещества.
Связи типа водородных не образуют атомы других элементов , поскольку силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей.
3.3.6 Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обуславливающие притяжение между молекулами. Эти силы позднее получили название ван-дер-ваальсовых сил – наиболее универсальный вид межмолекулярной связи. Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж/∙моль.
В зависимости от способа возникновения силы делятся на:
1) ориентационные (диполь-диполь или ион-диполь) - возникают между полярными молекулами или между ионами и полярными молекулами. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 10).
|
Рисунок 10 - Ориентационное взаимодействие |
||||
2) индукционные (диполь – индуцированный диполь или ион– индуцированный диполь) - возникают между полярными молекулами или ионами и неполярными молекулами, но способными к поляризации. Диполи могут воздействовать на неполярные молекулы, превращая их в индицированные (наведенные) диполи. (рисунок 11).
|
Рисунок 11 - Индукционное взаимодействие |
||||
3) дисперсионные (индуцированный диполь – индуцированный диполь) - возникают между неполярными молекулами, способными к поляризации. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается (рисунок 12).
|
Рисунок 12 - Дисперсионное взаимодействие |
|||||||
Единой теории химической связи не существует, условно химическую связь делят на ковалентную (универсальный вид связи), ионную(частный случай ковалентной связи), металлическую и водородную.
Ковалентная связь
Образование ковалентной связи возможно по трем механизмам: обменному, донорно-акцепторному и дативному (Льюиса).
Согласно обменному механизму образование ковалентной связи происходит за счет обобществления общих электронных пар. При этом каждый атом стремится приобрести оболочку инертного газа, т.е. получить завершенный внешний энергетический уровень. Образование химической связи по обменному типу изображают с использованием формул Льюиса, в которых каждый валентный электрон атома изображают точками (рис. 1).
Рис. 1 Образование ковалентной связи в молекуле HCl по обменному механизму
С развитием теории строения атома и квантовой механики образование ковалентной связи представляют, как перекрывание электронных орбиталей (рис. 2).

Рис. 2. Образование ковалентной связи за счет перекрывания электронных облаков
Чем больше перекрывание атомных орбиталей, тем прочнее связь, меньше длина связи и больше ее энергия. Ковалентная связь может образовываться за счет перекрывания разных орбиталей. В результате перекрывания s-s, s-p орбиталей, а также d-d, p-p, d-p орбиталей боковыми лопастями происходит образование – связи. Перпендикулярно линии, связывающей ядра 2-х атомов образуется – связь. Одна – и одна – связь способны образовывать кратную (двойную) ковалентную связь, характерную для органических веществ класса алкенов, алкадиенов и др. Одна – и две – связи образуют кратную (тройную) ковалентную связь, характерную для органических веществ класса алкинов (ацетиленов).
Образование ковалентной связи по донорно-акцепторному механизму рассмотрим на примере катиона аммония:
NH 3 + H + = NH 4 +
7 N 1s 2 2s 2 2p 3

Атом азота имеет свободную неподеленную пару электронов (электроны не участвующие в образовании химических связей внутри молекулы), а катион водорода свободную орбиталь, поэтому они являются донором и акцептором электронов, соответственно.
Дативный механизм образования ковалентной связи рассмотрим на примере молекулы хлора.
17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Атом хлора имеет и свободную неподеленную пару электронов и вакантные орбитали, следовательно, может проявлять свойства и донора и акцептора. Поэтому при образовании молекулы хлора, один атом хлора выступает в роли донора, а другой – акцептора.
Главными характеристиками ковалентной связи являются: насыщаемость (насыщенные связи образуются тогда, когда атом присоединяет к себе столько электронов, сколько ему позволяют его валентные возможности; ненасыщенные связи образуются, когда число присоединенных электронов меньше валентных возможностей атома); направленность (эта величина связана с геометрий молекулы и понятием «валентного угла» — угла между связями).
Ионная связь
Соединений с чистой ионной связью не бывает, хотя под этим понимают такое химически связанное состояние атомов, в котором устойчивое электронное окружение атома создается при полном переходе общей электронной плотности к атому более электроотрицательного элемента. Ионная связь возможна только между атомами электроотрицательных и электроположительных элементов, находящихся в состоянии разноименно заряженных ионов – катионов и анионов.
ОПРЕДЕЛЕНИЕ
Ионом называют электрически заряженные частицы, образуемые путем отрыва или присоединения электрона к атому.
При передаче электрона атомы металлов и неметаллов стремятся сформировать вокруг своего ядра устойчивую конфигурацию электронной оболочки. Атом неметалла создает вокруг своего ядра оболочку последующего инертного газа, а атом металла – предыдущего инертного газа (рис. 3).
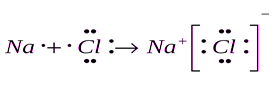
Рис. 3. Образование ионной связи на примере молекулы хлорида натрия
Молекулы, в которых в чистом виде существует ионная связь встречаются в парообразном состоянии вещества. Ионная связь очень прочная, в связи с этим вещества с этой связью имеют высокую температуру плавления. В отличии от ковалентной для ионной связи не характерны направленность и насыщаемость, поскольку электрическое поле, создаваемое ионами, действует одинаково на все ионы за счет сферической симметрии.
Металлическая связью
Металлическая связь реализуется только в металлах – это взаимодействие, удерживающее атомы металлов в единой решетке. В образовании связи участвуют только валентные электроны атомов металла, принадлежащие всему его объему. В металлах от атомов постоянно отрываются электроны, которые перемещаются по всей массе металла. Атомы металла, лишенные электронов, превращаются в положительно заряженные ионы, которые стремятся принять к себе движущиеся электроны. Этот непрерывный процесс формирует внутри металла так называемый «электронный газ», который прочно связывает между собой все атомы металла (рис. 4).
Металлическая связь прочная, поэтому для металлов характерна высокая температура плавления, а наличие «электронного газа» придают металлам ковкость и пластичность.
Водородная связь
Водородная связь – это специфическое межмолекулярное взаимодействие, т.к. ее возникновение и прочность зависят от химической природы вещества. Она образуется между молекулами, в которых атом водорода связан с атомом, обладающим высокой электроотрицательностью (O, N, S). Возникновение водородной связи зависит от двух причин, во-первых, атом водорода, связанный с электроотрицательным атомом не имеет электронов и может легко внедряться в электронные облака других атомов, а, во-вторых, обладая валентной s-орбиталью, атом водорода способен принимать неподеленную пару электронов электроотрицательного атома и образовывать с ним связь по донорно акцепторному механизму.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter