Какие существуют молекулы. Виды связей молекул веществ. Что будем делать с полученным материалом
Для понимания природы химической связи, обуславливающей образование молекул из атомов, а также кристаллов, необходимо рассмотреть квантовомеханическую модель атома с учетом волновых свойств электронов. Взаимодействие классических зарядов полностью описывается законом Кулона. Электрическое взаимодействие реальных электронов, обладающих волновыми свойствами, не может быть сведено к обычному кулоновскому.
Возможные расположения атомов в молекулах практически бесконечны. Молекулы производятся в почти бесконечном разнообразии с широким спектром структур и свойств. Тем не менее, можно выделить несколько основных типов молекул с учетом некоторых общих характеристик, которые могут иметь некоторые соединения. По существу, молекулы могут быть сгруппированы по типу соединения между их атомами, размеру их молекулярной структуры и составляющим их атомам.
Органические молекулы являются основными компонентами жизни. Хотя может быть трудно точно определить, что такое органическая молекула, общепринятым критерием является то, что они содержат углерод, за исключением нескольких очень простых соединений, которые не содержат углерода, но не считаются органическими, например диоксид углерода. Органические молекулы варьируются от небольших простых химических веществ на основе углерода, таких как этанол, гексан и уксусная кислота, до крупных сложных соединений, которые составляют живые системы, включая белки, сахара и жирные кислоты.
Рассмотрим, что происходит при сближении атомов. Во-первых, экспериментально доказано, что силы, удерживающие атомы в молекулах, вызваны взаимодействием внешних электронов. Электроны внутренних оболочек при этом остаются в прежних состояниях. Во-вторых, волновые функции внешних электронов довольно быстро, но плавно убывают при удалении от ядра. При сближении атомов размытые электронные облака внешних электронов перекрываются, что приводит к особому виду взаимодействия. Это взаимодействие не имеет аналога в классической физике – для классических зарядов проблема взаимного проникновения тел вообще не возникает. Оно проявляется в области перекрытия электронных облаков отдельных атомов. В такой ситуации появляется добавочная (помимо кулоновской) энергия взаимодействия электронов – «обменная энергия». При этом если спины электронов параллельны, энергия положительна, а электроны отталкиваются, препятствуя образованию молекулы. Если же спины электронов антипараллельны, обменная энергия отрицательна, и электроны притягиваются и будут стремиться образовать единую оболочку, которая окружит оба ядра. Ядра будут удерживаться на некотором расстоянии за счет сил кулоновского отталкивания.
Неорганические молекулы включают по существу все молекулы, которые не являются органическими. Существует много разных типов неорганических соединений, которые могут быть размещены в нескольких подкатегориях. Некоторые простые неорганические молекулы представляют собой воду, аммиак и перекись водорода. Многие другие сделаны путем добавления кислорода к различным элементам. К ним относятся оксид железа и хромовая кислота. Третьи - координационные комплексы, в которых несколько металлов, таких как кобальт, имеют «лиганды», такие как аммиак и хлор.
В атомах гелия два электрона заполненной К -оболочки обладают противоположными спинами, поэтому они не соединяются ни друг с другом, ни с другими атомами. Гелий – инертный газ. Два атома лития могут образовать молекулу, объединяя электроныL -слоя в одну оболочку. При этом электроныК -оболочек будут отталкиваться по тем же причинам, по которым отталкиваются атомы гелия. То есть химически активными будут лишь те электроны, которые не имеют парных по спину. Энергетически выгодное объединение электронов с противоположными спинами приводит к образованию молекулярной связи. Следует отметить, что атомы гелия вообще могут образовывать молекулу, но для этого необходимо, чтобы оба атома были в возбужденном состоянии – в первом и во втором слоях будет по одному неспаренному электрону. Такая молекула будет неустойчивой, поскольку энергия двух невозбужденных атомов будет меньше энергии молекулы.
Ионные неорганические соединения
Дополнительным классом неорганических соединений, представляющих многие виды, являются ионные молекулы. Это химические вещества, в которых два или более атомов удерживаются вместе электростатическим притяжением между противоположно заряженными атомами или ионами. Примеры включают поваренную соль, перхлорат калия и нитрат натрия. Эти соединения, как правило, легко растворяются в воде и делятся на их составляющие ионы при растворении.
Более 30 миллионов долларов стоило обнаружить то, что до сих пор не было известно. Клетки изучали на молекулярном уровне. Недавно открытое поле привело к созданию продукта, который мы все можем использовать. Это не лекарство, травы, витамины, минералы, соки или питательные вещества. В нем нет токсичных веществ и никаких побочных эффектов. Это продукт идеально сбалансированных редоксальных сигнальных молекул, который является первым в своем роде в мире. Исследования этих молекул привели к созданию команды многих экспертов в области здравоохранения.
Рассмотрим атом бериллия (Z = 4). В невозбужденном состоянии, согласно рис. 8.2, он не обладает неспаренными электронами – строение его второй оболочки такое же, как у химически инертного атома гелия.
Рис. 8.2. Электронная конфигурация атома бериллия
в основном и возбужденном состоянии
Однако, как показывает опыт, атом бериллия двухвалентен. Он, как и атом гелия, может обладать валентными электронами при возбуждении. Один из электронов атома гелия при возбуждении должен перейти на следующую оболочку, для этого требуется энергия ~ 20 эВ, которая не перекрывается обменной энергией, выделяющейся при образовании молекулы.
Более 1000 результатов их исследований можно найти в Интернете. Самуэльсон, основанный на 16-летних исследованиях и разработках, завершил процесс создания и стабилизации так называемого Молекулы редокс-сигналов. Этот процесс получил более 20 патентов и использует солевой раствор в качестве «носителя» для этих молекул. Это было до тех пор, пока ученые из университета сами не протестировали процесс и не подтвердили его эффективность.
Некоторые называют это самым большим научным открытием в области клеточной функции. Это затронет почти все научные области, связанные со здоровьем и благополучием. Полностью функциональная система иммунитета должна работать следующим образом. Каузальный агент вызывает преднамеренную реакцию органа, обычно воспаление. Это не так, потому что есть факторы, которые не могут быть достигнуты острым состоянием воспламенения и правом регенерации. Чтобы эти процессы протекали правильно, организм должен иметь доступ к окислению и восстановлению равновесного потомства.
При возбуждении атома бериллия возникают два валентных электрона в результате перехода одного из них из s -состояния вp -состояние в пределах одной оболочки (рис. 8.2). Это требует малой энергии, многократно перекрываемой за счет обменной энергии, выделяемой при образовании молекулы. Если молекула образуется за счет объединения валентных электронов в единую электронную оболочку, принято говорить оковалентной химической связи . Электронное облако, образующееся при этом, обладает симметрией относительно обоих атомов.
Система информации, которую использует организм, представляет собой химическую, акустическую, механическую вибрацию клеточных мембран, инфракрасных, электрических, магнитных, электромагнитных, фотонных, тепловых и термодинамических сигналов. Сигнализация Редокс - это функция, жизненно важная для жизни на нашей планете. Редокс-сигнальные молекулы создаются в каждой клетке организма и необходимы для иммунной системы и механизмов клеточного заживления. Они настолько жизненно важны для жизни, что без них вы умрете в течение нескольких секунд.
Другой тип молекулярной связи можно показать на примере молекулы NaF . У атома натрия первые две оболочки завершены, на третьей (n = 3) оболочке имеется одинs -электрон, энергия связи которого составляет 5.12 эВ. В атоме фтора завершена только первая оболочка, а на второй имеются 7 электронов, при этом один спин не насыщен. Поэтому атом фтора может легко присоединить восьмой электрон, перетянув его от атома натрия, и стать отрицательно заряженным ионом. Атом натрия при этом становится положительным ионом. Такой тип молекулярной связи называетсяионной химической связью .
Правильная доставка редоксальной сигнальной молекулы позволяет проводить клеточную обработку: поврежденные, дисфункциональные клетки исчезают, а на их месте появляются здоровые живые клетки. Редокс-сигнальные молекулы необходимы для здоровья вашей клетки; Вот почему ваш организм производит собственное питание. Но после достижения 12-летнего возраста наши клетки продуцируют все меньше и меньше молекул.
Что такое молекулы редокс-сигналов? Существует два типа преобразователей сигналов «Кому-катор» и «Привод». Эти два типа играют роль посланников и отвечают за общение между клетками всего нашего тела. Если вы хотите узнать больше об этих ссылках, посетите.
Энергия обменного взаимодействия в случае молекулы NaF составляет 4.13 эВ – это меньше энергии связи электрона в атоме натрия, и на первый взгляд образование данной молекулы энергетически не выгодно. Однако образовавшиеся ионы разных знаков при малых расстояниях (порядка 5Å) обладают энергией связи 2.9 эВ. Таким образом, энергия, удерживающая атомы в молекуле, оказывается равной 4.13 + 2.9 = 7.03 эВ, что значительно превышает энергию связи электрона в атоме (5.12 эВ). От взаимного проникновения ионы удерживаются отталкиванием завершенных оболочек.
Когда ячейкам необходимо выполнять различные функции, они генерируют два типа преобразователей сигналов. Антинейтроны эффективны в борьбе с вредом, вызванным свободными радикалами и окислительным стрессом; Однако они не могут действовать без действия сигнальными молекулами.
Поэтому для выполнения этой работы вам понадобится «Привод для редоксации». Они негативно влияют на наше здоровье. Это приводит к значительному повреждению клеток и снижению окислительно-восстановительной сигнализации. Исследователи и исследователи во всем мире производят ряд наборов для тестирования сигналов редокс, чтобы лучше понять их структуру, воздействие и воздействие. в отношении здоровья человека.
Молекулярной связи чисто ионного типа не существует, говорят о доли ионности и ковалентности. Но, если молекула состоит из одинаковых атомов, она имеет место чисто ковалентный тип связи.
Молекула является квантовой системой, для нее можно записать и решить уравнение Шредингера. Сложность уравнения сильно увеличивается при увеличении числа составляющих системы (электронов и ядер).
Рассмотрим самую простую из молекул – молекулу водорода. В ее состав входят два электрона и два протона (два ядра). Потенциальная энергия такой системы равна:
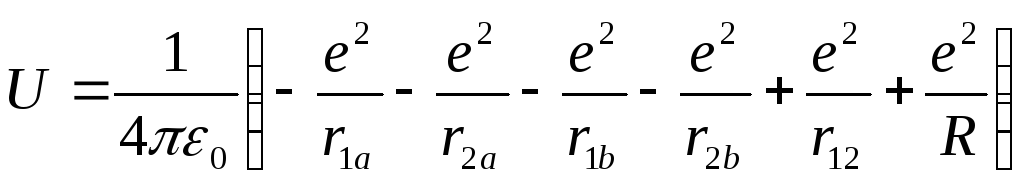 (8.14)
(8.14)
Ядра имеют массу, приблизительно в 2000 раз превышающую массу электрона. Поэтому в первом приближении ядра можно считать неподвижными. Такое приближение позволяет, значительно упростив, свести уравнение Шредингера к следующему виду:
 (8.15)
(8.15)
где U
– потенциальная
энергия (6.1), –
оператор Лапласа, содержащий координаты
одного электрона, а
–
оператор Лапласа, содержащий координаты
одного электрона, а – оператор Лапласа, содержащий координаты
другого электрона. Если считать, что
движения ядер и электронов не зависят
друг от друга, то уравнение (8.15) распадается
на два независимых уравнения, одно из
которых описывает состояние ядер, другое
– состояние электронов.
– оператор Лапласа, содержащий координаты
другого электрона. Если считать, что
движения ядер и электронов не зависят
друг от друга, то уравнение (8.15) распадается
на два независимых уравнения, одно из
которых описывает состояние ядер, другое
– состояние электронов.

Рис. 8.3. Энергия молекулы в зависимости от расстояния между атомами
Полная энергия движения и взаимодействия электронов в системе из двух атомов водорода оказывается зависящей от расстояния между ядрами атомов. Причем зависимость имеет различный характер при сближении атомов с параллельными или антипараллельными спинами. При удалении ядер друг от друга в обоих случаях наблюдается асимптотическое приближение энергии системы к значению E 0 , равному сумме энергий двух атомов. Эта величина равна энергии связи молекулы, соответственно именно такая энергия необходима, чтобы разрушить молекулу (энергия диссоциации ).
При сближении атомов, валентные электроны в которых имеют параллельные спины, наблюдается увеличение полной энергии системы двух атомов. В этом случае возможно только взаимное отталкивание атомов.
В случае сближения атомов с противоположно ориентированными спинами существует минимум энергии, который и соответствует образованию молекулы. Этот минимум определяется разницей между суммой энергий двух атомов и энергией их взаимодействия. Расстояние R 0 определяет равновесное расстояние между ядрами в молекуле для данной электронной конфигурации. При изменении электронной конфигурации молекулы, например при переходе молекулы в возбужденное состояние, меняется зависимость электронной энергии от расстояния между ядрамиU * (r ) (рис. 8.4). Это выражается в частности в том, что меняется равновесное расстояние между ядрами атомов, входящих в состав молекулы. Меняется также и энергия диссоциации молекулы.

Рис. 8.4. Потенциальные кривые молекулы в основном и возбужденном состоянии
Возможные изменения энергии молекулы определяются тремя видами движения, характерными для молекул.
1) При изменении электронной конфигурации (то есть в результате изменения периферической части молекулы) происходит наиболее заметное изменение энергии молекулы. Эту долю энергии обозначают как электронную энергию E e .
2) При заданной электронной конфигурации молекулы, ядра могут совершать колебательные движения относительно положения равновесия.
Можно определить энергию колебательного движения ядер, она квантуется и при малых колебаниях равна:
 (υ = 0, 1, 2,...)
(8.16)
(υ = 0, 1, 2,...)
(8.16)
где ω υ – классическая частота осциллятора,
υ –колебательное квантовое число , изменение которого при переходах подчиняется правилу отбора:∆υ = ± 1 (8.17)
3) Наконец, необходимо учитывать, что молекула как целое совершает вращательное движение относительно центра масс. Такая система имеет момент инерции, и ее движение может быть описано с помощью угловой скорости ω r . В этом случае энергия будет равна:
 (8.18)
(8.18)
где I – момент инерции молекулы относительно оси, проходящей через центр масс.
M = Jω r – момент импульса системы, который также может принимать лишь определенные дискретные значения, поскольку молекула является системой с квантовыми свойствами:
 (J
= 0, 1, 2,...)
(8.19)
(J
= 0, 1, 2,...)
(8.19)
здесь J – квантовое число момента импульса иливращательное квантовое число .
Таким образом, значение вращательной
энергии оказывается квантуемым:
 (8.20)
(8.20)
Энергетические переходы молекулы
происходят согласно правилу отбора
вращательного квантового числа:
 (8.21)
(8.21)
Таким образом, полная энергия молекулы равна:
 (8.22)
(8.22)
Каждое из слагаемых полной энергии любой молекулы имеет определенный порядок величины, и определяет расстояние между соответствующими уровнями на энергетической схеме молекулы. Электронная энергия E e составляет величину порядка нескольких эВ (1 – 10 эВ); колебательная энергия –E υ ≈ 0.01 – 0.1 эВ; вращательная энергия –E r ≈ 10 –5 – 10 –3 эВ.
Спектры молекул, в отличие от линейчатых спектров атомов, представляют собой набор полос, состоящих из нескольких линий. В зависимости от того, изменение какого вида энергии происходит при испускании молекулой фотона, различают три вида полос: вращательные, колебательно-вращательные и электронно-колебательные .
Электронно-колебательные переходы в спектрах молекул имеют наибольшую энергию (порядка нескольких эВ). В данных переходах задействованы электронные уровни энергии, (E " e иE "" e на рис. 7.5), а также колебательные уровни (напримерυ" = 1 иυ"" = 0 или любые другие колебательные уровни, но обязательно один должен быть из колебательных подуровней электронного состоянияE " e , другой из колебательных подуровней электронного состоянияE "" e ). Для полос электронно-колебательного типа характерно наличие резкого края с одной стороны, называемого кантом полосы, и размытого края с другой.
![]()
Рис. 8.5. Энергетическая схема молекулы
Полосы, соответствующие колебательно вращательным переходам расположены в диапазоне энергий от 0.01 эВ до 1.5 эВ. При этом положение полосы в спектре (т.е. ее частоту или длину волны или энергию) определяет колебательная составляющая (это могут быть два колебательных состояния υ" =i иυ" =i ± 1 одного и того же электронного уровня). Вращательная составляющаяJ изменяется в пределах данного колебательного уровня и определяет тонкую структуру полосы (т.е. наличие и взаимное расположение линий в пределах данной полосы).
Вращательные полосы состоят из линий, соответствующих переходам между только вращательными состояниями в пределах одного колебательного уровня. Энергия фотона, под действием которого возможны такие переходы довольно мала (порядка 0.001 эВ), следовательно вращательные полосы расположены в далекой инфракрасной области.
Спектры молекул так же индивидуальны для различных органических и неорганических соединений, как спектры различных атомов. Накопленный учеными-спектроскопистами опыт позволяет по спектру излучения молекул (или смеси молекул) определить наличие и даже процентное содержание конкретного вещества в пробе. Важной особенностью подобных методов является низкий порог чувствительности – даже наличие очень малого количества какого-либо вещества доступно для исследования. Это широко используется в настоящее время для экспертного анализа во многих лабораториях. В качестве примера можно привести допинг-контроль на спортивных соревнованиях; криминалистические экспертизы на содержание наркотических веществ в крови или непосредственно идентификация найденного вещества как наркотического или напротив, как разрешенного медицинского препарата; экспертиза товаров народного потребления (продуктов питания, бытовой химии, любых предметов) на содержание вредных и запрещенных соединений.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
КУРС ЛЕКЦІЙ
З дисципліни
„Електротехнічні матеріали”
(для студентів спеціальностей 6.090601 – „Електричні станції”, 6.090602 „Електричні системи і мережі”, 6.090603 „Електротехнічні системи електроспоживання”)
Розглянуто на засіданні кафедри
„Електропостачання промислових
підприємств та міст”
Протокол № від
Затверджено на засіданні
учбово-видавничої ради ДонНТУ
Протокол № від
Донецьк – ДонНТУ – 2006
УДК 621.38.002.3 (075.8)
С.В. Шлепньов. Лекції за курсом „Електротехнічні матеріали”. – Донецьк, ДонНТУ, 2006. – 96 с.
У курсі лекцій розглянуті основні питання дисципліни „Електротехнічні матеріали”. Наведені відомості про діелектрики, провідники, напівпровідники і магнітні матеріали. Описані останні досягнення науки і техніки в галузі електротехнічних матеріалів і електроматеріалознавства, наприклад явище зверхтемпературної надпровідності, нові способи отримання особо чистих напівпровідникових матеріалів та інше.
Лекції призначені для студентів спеціальностей 6.090601 „Електричні станції”, 6.090602 „Електричні системи і мережі”, 6.090603 „Електротехнічні системи електроспоживання”.
Укладач доц. С.В. Шлепньов
Рецензент проф. А.М. Бурковьский
Общие сведения об ЭТМ
ЭТМ называются материалы, которые обладают определенными свойствами и характеристиками по отношению к электромагнитному полю и используются в электротехнике с учетом этих свойств и характеристик.
Материаловедением или молекулярной технологией, называется наука о структуре и свойствах материалов.
В широком смысле электротехническими материалами считаются материалы, которые используются в производстве электротехнических изделий. В узком смысле электротехническими считаются материалы, которые обладают особыми свойствами по отношению к действию электромагнитного поля.
Материалы, которые обладают вспомогательными свойствами и на которые либо слабо действует, либо вообще не действует электромагнитное поле, называются вспомогательными или конструкционными.
Критерии систематизации ЭТМ:
1.Область применения.
2.Химический состав.
3.Агрегатное состояние.
4.Структура.
5.Происхождение.
Виды связей молекул веществ
Большинство веществ состоит из атомов, ионов и молекул. Ядро атома состоит из протонов и нейтронов и имеет положительный заряд. Вокруг ядра располагается(ются) электронная(ые) оболочка(и) (орбиталь(и)), на которой(ых) находятся электрон или электроны (это зависит от порядкового номера химического элемента в периодической таблице Д.И. Менделеева). Размеры атомов составляют в среднем 0.1 нм. Если атом лишается части электронов, его размер уменьшается и он становится положительно заряженным ионом. Если атом присоединяет к себе электрон, он становится отрицательно заряженным ионом и увеличивается в размерах.
Существует четыре вида связи молекул:
1. Ковалентная связь.
2. Ионная связь.
3. Металлическая связь.
4. Молекулярная связь (ковалентная внутримолякулярная, связь ван дер Ваальса).
Ковалентная связь образуется при обобществлении электронов двумя соседними атомами. Может наблюдаться в таких соединениях: O 2 , Н 2 , Cl 2, СО (рис. 1).
Молекулы, у которых центры одинаковых по величине положительных и отрицательных зарядов совпадают, называются неполярными или нейтральными.
Рисунок 1 – Схематическое изображение двухатомной молекулы с ковалентной связью
![]()

Рисунок 2 – Структура и плотная упаковка ионов хлористого натрия (а) и неплотная упаковка хлористого цезия (б)
Молекулы, у которых центры положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии друг от друга, называются полярными или дипольными. Они характеризуются дипольным моментом:
где q – заряд, Кл;
l – расстояние между центрами положительного и отрицательного зарядов.
Ковалентная связь может быть как в молекулах (в трех агрегатных состояниях), так и между атомами, которые образуют кристаллическую решетку кристалла, например в алмазе, германии, кремнии. Ковалентной связью могут удерживаться не только одинаковые атомы
Cl -Cl , C C ,
но и различные
Ионная связь обусловлена силами притяжения между положительными и отрицательными ионами. Твердые тела ионной структуры характеризуются высокой температурой плавления и повышенной механической прочностью. Плотную упаковку ионов имеет решетка NaCl , неплотную – CsCl (рис. 2).
Металлическая связь приводит к образованию твердых кристаллических тел. Металлы можно рассматривать как системы, в узлах кристаллических решеток которых располагаются положительные ионы (положительные остовы), а между узлами расположены свободные коллективизированные электроны (электронный газ) (см. рис. 3). Силы притяжения между положительными остовами и электронами обуславливают монолитность металла, высокие значения механической прочности и температуры плавления. Скольжение отдельных слоев атомных остовов объясняет хорошую ковкость металла. Наличие электронов в металле объясняет высокую электропроводность и теплопроводность металла, а также его блеск.
Молекулярная связь (ковалентная внутримолекулярная) или связь ван дер Ваальса.
Такой вид связи наблюдается в некоторых веществах между молекулами с внутримолекулярными ковалентными связями. В этом случае притяжение между молекулами объясняется согласованным движением валентных электронов в них. Причем эти электроны всегда максимально удалены друг от друга и максимально приближены к положительным зарядам. Поэтому сила притяжения между ядрами и электронами больше, чемсила взаимного отталкивания между электронами (рис. 4). Такой вид связи непрочен, наблюдается, например, у парафина, который имеет низкую температуру плавления.
Рисунок 3 – Схема строения метал-
лического проводника
Рисунок 4 – Схематическое
изображение двух взаимодействующих
молекул (связь ван дер Ваальса)
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter