Хлорметан вид химической связи водородная. Водородная связь. Особенности водородной связи
ВОДОРОДНАЯ СВЯЗЬ (Н-связь)- особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь - глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Водородная связь представляет собой особый тип диполь-дипольного притяжения, который возникает, когда атом водорода, связанный с сильно электроотрицательным атомом, существует вблизи другого электроотрицательного атома с одиночной парой электронов. Эти связи, как правило, сильнее, чем обычные, но более слабые, чем истинные.
Особенности водородной связи
Для возникновения водородной связи должны присутствовать как донор водорода, так и присутствующий акцептор. Акцептором водорода является соседний электроотрицательный ион или молекула, и должен иметь одиночную электронную пару для образования водородной связи. Поскольку донор водорода сильно электроотрицателен, он приближает ковалентно связанную электронную пару ближе к своему ядру и от атома водорода. Затем атом водорода остается частичным положительным зарядом, создавая диполь-дипольное притяжение между атомом водорода, связанным с донором, и одиночной электронной парой на акцепторе.
Особенности водородной связи.
Отличительная черта водородной связи - сравнительно низкая прочность, ее энергия в 5-10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.
Свойства и эффекты водородных связей
Водородные связи могут происходить в пределах одной молекулы, между двумя одинаковыми молекулами или между двумя непохожими молекулами. Внутримолекулярные водородные связи: внутримолекулярные водородные связи представляют собой те, которые происходят внутри одной молекулы. Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Чтобы это произошло, как донор водорода, акцептор должен присутствовать в одной молекуле, и они должны находиться в непосредственной близости друг от друга в молекуле. Они могут встречаться между любым количеством подобных или в отличие от молекул, пока доноры и акцепторы водорода присутствуют в положениях, в которых они могут взаимодействовать. Например, межмолекулярные водородные связи могут происходить между \\ молекулами в одиночку, между \\ молекулами в одиночку или между \\ и \\ молекулами. Когда мы рассматриваем точки кипения молекул, мы обычно ожидаем, что молекулы с более крупными молярными массами имеют более высокие нормальные температуры кипения, чем молекулы с меньшими молярными массами.
В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов - способность оттягивать на себя электроны химической связи от атома - партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью возникает частичный отрицательный заряд d- , а на атоме-партнере - положительный d+, химическая связь при этом поляризуется: А d- -Н d+ .
Большие молекулы имеют больше пространства для распределения электронов и, следовательно, больше возможностей для мгновенного дипольного момента. Однако, рассматривая приведенную ниже таблицу, мы видим, что это не всегда так. Мы видим, что \\, \\ и \\ имеют более высокие точки кипения, чем то же самое соединение, образованное между водородом, и следующий элемент, движущийся вниз по его соответствующей группе, что указывает на то, что первые имеют большие межмолекулярные силы. Это связано с тем, что \\, \\ и \\ все проявляют водородную связь, тогда как другие - нет.
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия.
В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Н d+ -А d- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare - дарить, жертвовать), а Б - его акцептором (лат. acceptor - приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
Кроме того, \\ имеет меньшую молярную массу, чем \\, но участвует в большем количестве связей водорода на молекулу, поэтому ее точка кипения, следовательно, выше. Тот же эффект, который наблюдается при температуре кипения в результате водородной связи, также может наблюдаться в некоторых веществах. Те вещества, которые способны образовывать водородные связи, имеют тенденцию иметь более высокую вязкость, чем те, которые этого не делают. Вещества, которые имеют возможность для множественных водородных связей, демонстрируют еще более высокие вязкости.
Атомов - доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк.
Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н 2 O, Н 2 S, Н 2 Se, и Н 2 Te, они обратили внимание на то, что первый член этого ряда - вода - кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение.
Факторы, препятствующие водородному связыванию
Электроотрицательность: водородное связывание не может происходить без существенных различий электроотрицательности между водородом и атомом, к которому он связан. Таким образом, мы видим молекулы, такие как \\, которые не участвуют в водородных связях. \\ демонстрирует тригональную пирамидальную молекулярную геометрию, подобную аммонии, но в отличие от \\ она не может иметь водородную связь. Оба атома имеют электроотрицательность 1, и, следовательно, не происходит дипольного момента. Это предотвращает получение водородной связи частичного положительного заряда, необходимого для водородной связи с одиночной электронной парой в другой молекуле. Размер атома: размер доноров и акцепторов также может влиять на способность к водородной связи. Когда радиусы двух атомов сильно различаются или велики, их ядра не могут достичь непосредственной близости, когда они взаимодействуют, что приводит к слабому взаимодействию. Это связано с подобием электроотрицательности фосфора и водорода. . Теория переноса сцепления в сосудистых растениях использует водородную связь для объяснения многих ключевых компонентов движения воды через ксилему растений и других сосудов.
Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН 3 , Н 3 P, Н 3 As, Н 3 Sb. Его истинная температура кипения (-33° С) на 80° С выше ожидаемого значения.
При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи.
Внутри сосуда молекулы воды связаны водородной связью не только друг с другом, но и с целлюлозой цепь, которая содержит стенку растительных клеток, что создает своего рода капиллярную трубку, которая позволяет возникнуть, поскольку сосуд относительно невелик. Этот механизм позволяет растениям подтягивать воду в свои корни. Кроме того, водородная связь может создать длинную цепь молекулы воды, которые могут преодолевать силу тяжести и путешествовать до больших высот листьев.
Водородная связь присутствует в изобилии во вторичной структуре, а также умеренно в третичной конформации. Вторичная структура белка включает взаимодействия между соседними полипептидными скелетами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Хотя они относительно слабы, эти связи обеспечивают большую устойчивость к структуре вторичного белка, потому что они повторяются много раз. Эти взаимодействия происходят из-за водородной связи между молекулами воды вокруг гидрофоба и дальнейшего усиления конформации.
Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) - результат образования водородных связей.
В настоящее время надежный способ обнаружить Н-связи дают спектральные методы (чаще всего инфракрасная спектроскопия). Спектральные характеристики групп АН, связанных водородными связями, заметно отличаются от тех случаев, когда такая связь отсутствует. Кроме того, если структурные исследования показывают, что расстояние между атомами Б - Н меньше суммы Ван-дер-Ваальсовых радиусов, то считают, что присутствие Н-связи установлено.
- Химия: Центральная наука. 11-е изд.
- Общая химия: основные понятия. 3-е изд.
В этом случае водородная связь действует как мост между двумя атомами, где один атом удерживается ковалентной связью, а другой атом удерживается водородной связью. В вышеприведенной структуре водородная связь изображена пунктирной линией, и она показана сплошной линией.
Помимо повышенной температуры кипения водородные связи проявляются себя также при формировании кристаллической структуры вещества, повышая его температуру плавления. В кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул:
Причина образования водородной связи
Таким образом, можно сказать, что водородная связь является просто привлекательной силой, которая связывает атом водорода одной молекулы с электроотрицательными атомами другой молекулы. Атом водорода связан с сильно электроотрицательным элементом, поэтому общая пара электронов удаляется от атома водорода к электроотрицательному атому. Атом водорода становится электроположительным относительно электроотрицательного элемента. Это приводит к развитию положительного заряда над атомом водорода и частичного отрицательного заряда над электроотрицательным элементом.
![]()
Борная кислота В(ОН) 3 имеет слоистую кристаллическую структуру, каждая молекула связана водородными связями с тремя другими молекулами. Упаковка молекул в слое образует паркетный узор, собранный из шестиугольников:

Большинство органических веществ не растворимо в воде, когда такое правило нарушается, то, чаще всего, это результат вмешательства водородных связей.
Это дополнительно приводит к образованию полярной молекулы с электростатической силой притяжения. Величина Н-связи зависит от физического состояния соединений. Он достигает максимального значения и минимального в газообразном состоянии. Этот тип образования связей происходит между различными молекулами одинаковых или разных соединений. Этот тип образования связей происходит, когда атом водорода находится между двумя электроотрицательными элементами, присутствующими в одной и той же молекуле.
- Межмолекулярная водородная связь.
- Например, водородная связь в воде и спирте.
- Внутримолекулярная водородная связь.
Кислород и азот - основные доноры протонов, они берут на себя функцию атома А в рассмотренной ранее триаде Б···Н d+ -А d- . Они же, чаще всего, выступают в роли акцепторов (атом Б). Благодаря этому некоторые органические вещества, содержащие O и N в роли атома Б, могут растворяться в воде (роль атома А исполняет кислород воды). Водородные связи между органическим веществом и водой помогают «растащить» молекулы органического вещества, переводя его в водный раствор.
Водородная связь оказывает очень сильное влияние на свойства и структуру многих соединений и является причиной аномального расширения воды. Водородная связь между донором азота и акцептором кислорода. Расстояния, показанные в Å, типичны для найденных в белках. Пунктирная водородная связь является нековалентной и переменной по длине, ~ 5-5 Å. Водородные связи являются нековалентными связями, которые происходят, когда донорный атом подает свой ковалентно связанный атом водорода на электроотрицательный акцепторный атом.
Не имея гидрогенов, эти последние не могут служить донорами. Углеродные атомы не имеют достаточной электроотрицательности, чтобы служить в качестве энергетически значимых доноров или акцепторов водородной связи. Средние донорно-акцепторные расстояния в элементах вторичной структуры белка близки к 0 Å, как и между основаниями в спаривании Уотсона-Крика.
Существует эмпирическое правило: если органическое вещество содержит не более трех атомов углерода на один атом кислорода, то оно легко растворяется в воде:

Бензол весьма незначительно растворим в воде, но если заменить одну группу СН на N, то получим пиридин С 5 Н 5 N, который смешивается с водой в любых соотношениях.
Такое голеное ядерное ядро оказывает сильное электростатическое притяжение на электроотрицательный атом соседней молекулы. Взаимодействие между атомом водорода одной молекулы и электроотрицательным атомом другой молекулы называется водородной связью. Таким образом, водородная связь определяется как электростатическая сила притяжения, которая существует между ковалентно связанным атомом водорода одной молекулы и электроотрицательным атомом другой молекулы. Водородная связь представлена пунктирной линией.
Можно отметить, что атом водорода действует как мост между электроотрицательными атомами двух разных молекул, один атом связан через ковалентную связь, а другой связан через водородную связь. Однако атом водорода не лежит в центрах двух электроотрицательных атомов, потому что водородная связь и ковалентная связь не имеют такой же прочности.
Водородные связи могут проявить себя и в неводных растворах, когда на водороде возникает частичный положительный заряд, а рядом находится молекула, содержащая «хороший» акцептор, как правило кислород. Например, хлороформ HCCl 3 растворяет жирные кислоты, а ацетилен HCєCH растворим в ацетоне:
Этот факт нашел важное техническое применение, ацетилен, находящийся под давлением, очень чувствителен к легким сотрясениям и легко взрывается, а его раствор в ацетоне под давлением безопасен в обращении.
Водородная связь намного слабее, чем ковалентная связь, и ее прочность составляет от 5 кДж. Моль-1 до 5 кДж. Моль -1. Сила водородной связи определяется следующими факторами. Степень поляризации внутри молекулы. Более высокая электроотрицательность атома больше поляризации, и больше будет сила водородной связи. Размер электроотрицательного атома должен быть небольшим.
На электроотрицательном атоме должна присутствовать одинокая пара электронов, которая может указывать на Н-атом соседней или близкой молекулы. Угол между тремя вовлеченными атомами должен составлять 180 °. Можно отметить, что по мере уменьшения угла сила Н-связи также уменьшается и нет, Н-связывание происходит, когда угол падает ниже 140 °.
Важную роль играют водородные связи в полимерах и биополимерах. В целлюлозе - основном компоненте древесины - гидроксильные группы, расположены в виде боковых групп полимерной цепи, собранной из циклических фрагментов. Несмотря на сравнительно слабую энергию каждой отдельной Н-связи, их взаимодействие на всем протяжении полимерной молекулы приводит к столь мощному межмолекулярному взаимодействию, что растворение целлюлозы становится возможным лишь при использовании экзотического высокополярного растворителя - реактива Швейцера (аммиачный комплекс гидроксида меди).
Водородная связь (Н-связь) – это связь, образуемая протонированным атомом водорода с сильноэлектроотцательным атомом той же или другой молекулы. В обычных условиях валентность водорода равна 1, и он способен обобществлять с другими атомами одну электронную пару, образуя ковалентную связь: атом водорода может присоединять электрон, образуя гидрид-ион Н + .
Атом водорода обладает особенностью, отличающей его от всех остальных атомов: отдавая свой электрон, он остается в виде ядра без электронов, т.е. в виде частицы, диаметр, которой в тысячи раз меньше диаметра остальных атомов. При отсутствии электронов ион Н + не отталкивается электронными оболочками других атомов или ионов, а наоборот, притягивается; он может близко подходить к другим атомам, взаимодействовать с их электронами и даже внедряться в их электронные оболочки. В жидкостях Н + -ионы большей частью не сохраняется в виде самостоятельной частицы, а связываются с молекулами двух веществ: в воде с молекулами воды, образуя ион Н 3 О + -ион гидроксония; с молекулой аммиака – NH 4 + -ион аммония.
Будучи связанным с атомом одного из наиболее электроотрицательных элементов: с атомом фтора, кислорода, хлора и азота, атом водорода приобретает относительно высокий положительный заряд, не превышающий единицу. Так как этот заряд сосредоточен на чрезвычайно малом атомном остове, он сильно приближается к другому атому, несущему отрицательный заряд. Это вызывает образование довольно сильной диполь-дипольной связи с энергией 20-30 кДж/моль и больше. Водородная связь возникает в результате междипольного взаимодействия двух сильно полярных связей, принадлежащих различным молекулам или одной и той же молекуле. Она слабее обычной ковалентной связи, энергия которой составляет приблизительно 125-420 кДж/моль и может усиливаться вследствие взаимной поляризации связей, обусловленной указанными особенностями водородного атома. Водородная связь (Н-связь) обозначается Х-Н××××Х.
Атом водорода, участвующий в водородной связи, может располагаться точно посередине между двумя сильноотрицательными атомами – симметричное расположение или же смещаться ближе к тому из них, который имеет большую электроотрицательность – несимметричное расположение.
Энергии водородной связи достаточно, чтобы при обычных и пониженных температурах вызывать заметную диссоциацию молекул. Фтористый водород даже вблизи температуры кипения имеет средний состав (HF) 4 . Ассоциация приводит к аномально высоким температурам плавления и кипения фтороводорода. Существование димера H 2 F 2 объясняет образование кислых солей типа KHF 2 ×NaHF 2 . Тот факт, что фтористоводородная кислота, в отличие от хлористоводородной, бромистоводородной и иодистоводородной, представляет собой слабую кислоту (К д = 7×10 -4) – тоже является следствием ассоциации молекул HF из-за водородных связей.
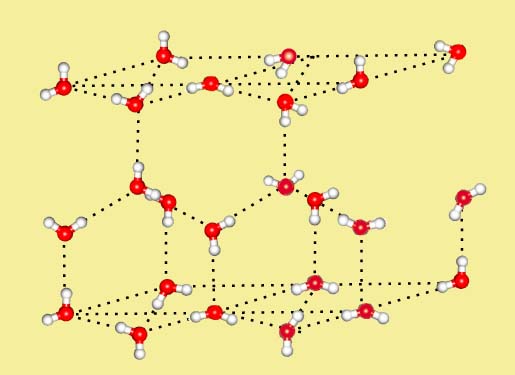
При наличии несимметричной водородной связи, которая возникает в соединениях кислорода и азота, водород располагается немного ближе к одному из двух соседствующих атомов, здесь межмолекулярная Н-связь . Каждая молекула Н 2 О участвует в образовании двух Н-связей, так что атом кислорода оказывается связанным с четырьмя атомами водорода. Ассоциированные молекулы воды образуют ажурную пространственную структуру, где каждый атом кислорода располагается в центре тетраэдра, а в углах находятся атомы водорода.
Ажурная пространственная структура воды
Ажурной структурой льда объясняется его меньшая плотность, чем воды. При плавлении часть Н-связей рвется и увеличивается плотность воды, т.к. молекулы располагаются более плотно. Рентгеновское исследование показало, что для большей части молекул в жидкой воде сохраняется также тетраэдрическое окружение: расположение соседних молекул почти такое же, как и в кристалле льда, а в последующем слое повторяется
некоторое отклонение от указанной упорядоченности; отклонение увеличивается по мере удаления от взятой молекулы. Для воды характерно наличие «ближнего порядка» как и для других жидкостей, и в меньшей степени, по сравнению с другими жидкостями, наличие «дальнего порядка». Этим объясняется наличие кристаллической структуры в воде.
Свойства воды такие как, большие значения теплоемкости и теплоты испарения, аномально высокие температуры плавления и кипения, высокая диэлектрическая проницаемость – из-за связанности молекул воды водородными связями. Без Н-связей t пл.воды = -100 о С, t кип.воды = -80 о С.
Водородные связи присутствуют в жидком аммиаке. Водородный атом, связанный с углеродом, может приобрести способность образовывать водородную связь, если остальные валентности углерода насыщаются сильно электроотрицательными атомами или соответствующими атомными группами, например, хлороформ (СНСl 3), пентахлорэтан (CCl 3 -CHCl 2), т.е. соседство электроотрицательных атомов может активировать образование водородной связи у атомов СН-групп, хотя электроотрицательность атомов С и Н почти одинакова. Этим объясняется возникновение Н-связей между молекулами в жидких HCN, CHF 3 и др.
Водородная связь свойственна любым агрегатным состояниям вещества. Она образуется между одинаковыми и между различными молекулами, между различными частями одной и той же молекулы – внутримолекулярная водородная связь . Наиболее распространенной является Н-связь между молекулами, содержащими гидроксильные группы ОН - .
Простые эфиры даже с большей молярной массой более летучи, чем спирты, так как в эфирах все атомы водорода связаны с атомами углерода и не способны образовывать Н-связи.
Велика роль Н-связи в биохимических системах. Свойства белков и нуклеиновых кислот в значительной степени обусловлены наличием водородной связи. Н-связь играет большую роль в процессах растворения. Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, поэтому эти связи играют важную роль в химии процессов жизнедеятельности.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter