Дайте определение сложного вещества. Строение вещества
Исходя из основных положений атомно-молекулярного учения, можно дать определения простого и сложного вещества .
Простыми веществами называются вещества, состоящие из атомов одного химического элемента.
Например:
O 2 , N 2 , S 8 .
Сложными веществами называются вещества, состоящие из атомов различных химических элементов.
Например:
Н 2 О, Н 2 SО 4 , CuCl 2 .
Следует заметить, что такое сложное вещество, как, например, вода Н 2 О, состоит не из водорода и кислорода (это названия простых веществ – водорода – Н 2 и кислорода – O 2), а из атомов элемента водорода – Н и атомов элемента кислорода – O.
Некоторые химические элементы способны образовывать несколько простых веществ, отличающихся друг от друга по строению и свойствам. В настоящее время известно более 400 простых веществ. Так, элемент углерод образует простые вещества: графит, алмаз, карбин и фулерен . При сгорании каждого из этих веществ образуется только оксид углерода (IV) СО 2 . Это подтверждает то, что эти простые вещества состоят из атомов одного и того же элемента С углерода.
Явление, при котором один и тот же элемент может образовать несколько простых веществ, называется аллотропией , а образуемые при этом простые вещества – аллотропными модификациями.
Примером аллотропных модификаций могут быть простые вещества – кислород О 2 и озон О 3 , образованные атомами одного и того же элемента – кислорода.
Явление аллотропии вызывается двумя причинами:
различным числом атомов в молекуле, например, кислород О 2 и озон О 3 ,
различным строением кристаллической решетки и образованием различных кристаллических форм, например, алмаз, графит, карбин и фулерен.
Способность вещества участвовать в тех или иных химических реакциях характеризует химические свойства вещества.
Химические явления (процессы) – это процессы, в результате которых из одних веществ образуются другие вещества.
Если в результате протекания процесса химическая природа вещества не меняется, то такие процессы считаются физическими .
Примерами физических процессов традиционно считаются изменения агрегатного состояния вещества: плавление ионных кристаллов некоторых солей, плавление металлов, испарение воды и других жидкостей и т.д.
Следует заметить, что такой процесс, как растворение, считают физико-химическим , и, в данном случае, границы между химическими и физическими явлениями достаточно условны.
Принято различать чистые (химически чистые) вещества и смеси веществ.
Чистыми или индивидуальными веществами называют вещества, состоящие из частиц одного вида (содержащие одинаковые структурные единицы).
Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ).
Чистые вещества характеризуются постоянством физических свойств, например, температурой плавления (Т пл) и температурой кипения (Т кип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей.
Если система образована смешиванием нескольких чистых веществ, причем их свойства при этом не изменились и ее можно разделить с помощью физических методов на исходные вещества, то такая система называется смесью . Почва, морская вода, воздух – все это примеры различных смесей. Вещества, входящие в состав смеси, называются компонентами . Содержание компонентов в смеси может меняться в широких пределах.
Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств. Среди большого числа методов, используемых для разделения и очистки веществ, можно назвать:
фильтрование,
отстаивание с последующей декантацией,
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Следует заметить, что на практике вещества, называемые «чистыми», являются таковыми лишь условно. Очистка веществ представляет сложную задачу и получение абсолютно чистых веществ, содержащих структурные единицы только одного вида, практически невозможно.
Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.
1. Различаем атом и молекулу
Из предыдущего курса «Природоведение» вы уже знаете, что все вещества состоят из мелких частичек - молекул и атомов. Вы также знаете, что первичные составные части вещества - атомы - имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (H), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса» вы уже познакомились в § 9. Что такое «химические свойства», вы узнаете из курса химии.
По положению на 2005 год науке известны только 116 различных видов атомов. «He может быть,- возразите вы.- Как это, только 116? Каждый из нас с легкостью перечислит 200-300, а может быть, и больше различных веществ». Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул.
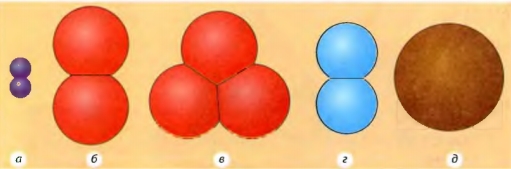
Рис. 2.11. Модели молекул некоторых веществ: а - метана (CH 4); б - серной кислоты (H 2 SO 4); в - воды (H 2 O). (Синие шарики - атомы водорода, красные - кислорода, зеленые - серы, желтые - углерода.)
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов.
Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква - это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу .
На рис. 2.11, а вы видите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,- это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы - слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
2. Знакомимся с простыми и сложными веществами
Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например, «я», «а-а...», «у-у-у...»)... Так же и с веществами. Некоторые из них состоят только из одного вида атомов (одного химического элемента) и потому называются простыми (см. рис. 2.12). Примерами таких веществ является углерод, железо и др.
Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются - сложные (см. рис. 2.11).

- Контрольные вопросы
1. Сколько разных видов атомов известно науке? Чем они отличаются друг от друга?
2. Какие вещества называют простыми? Приведите примеры.
3. Приведите примеры некоторых сложных веществ. Из каких атомов они состоят?
4. Как можно доказать, что между частичками вещества существуют промежутки?
5. Как показать, что атомы и молекулы очень малы?
6. В переводе с греческого языка «атом» означает «неделимый». Так ли это?
- Упражнения
1. Можем ли мы утверждать, что объем вещества в сосуде равняется сумме объемов молекул, из которых это вещество состоит?
2. Можем ли мы изменить объем тела, не изменяя количества молекул в нем? Как это сделать?
3. Известно, что при одинаковых условиях разные газы в одинаковом объеме содержат одно и то же количество молекул, а плотности газов различны. Чем можно объяснить расхождение в плотности газов?
4. Вычислите, сколько приблизительно молекул можно разместить вдоль отрезка длиной 0,5 мм. Диаметр молекулы считать равным 0,0000000001 м.
5. Известно, что наша Галактика Млечный Путь насчитывает около 9 млрд звезд. Во сколько раз количество молекул в 1 см 3 воздуха, равное (при нормальных условиях) 3 10 10 , больше указанного количества звезд?
6*.Площадь пленки, которую образует на поверхности воды капля масла объемом 0,005 мм 3 , не может превышать 50 см 2 . Какой вывод относительно размера молекул масла следует из этого факта?
- Экспериментальные задания
1. Растворите крупинку краски в воде, налитой в прозрачный сосуд. Отлейте немного окрашенной воды в другой сосуд и долейте чистой воды. Сравните окраску раствора в первом и втором сосудах. Аналогично разбавьте раствор еще несколько раз. Сравните окраску последнего раствора с чистой водой. Объясните результат.
2. Сделайте из цветного пластилина модели двух молекул воды. Составьте из этих моделей модели молекул водорода и кислорода.
- Физика и техника в Украине
Георгий Вячеславович Курдюмов (1902-1996) - выдающийся металлофизик, профессор, академик российской и украинской академий наук. На протяжении длительного времени он работал в Днепропетровске и Киеве, где создал современные научные школы по исследованию физики металлов и сплавов.
Наиболее важными результатами его научной деятельности с практической точки зрения было создание научных основ термической обработки металлов - средств существенного упрочнения сталей - и создание новых материалов с уникальными свойствами.
Академик Курдюмов также известен своими фундаментальными исследованиями кристаллической структуры сталей и открытием так называемого «эффекта Курдюмова».
Президиум HAH Украины ввел премию им. Г. В. Курдюмова.
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. - X.: Издательство «Ранок», 2007. - 192 с.: ил.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииТема: Простые и сложные вещества. Химический элемент.
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все - от песчинок малых до планет -
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент”. Что общего и чем эти понятия различаются?
Химический элемент – это атомы одного и того же вида. Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
В настоящее время известно 115 химических элементов, которые образуют около 500простых веществ.
Самородное золото - простое вещество.
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией. Например, элемент кислород O имеет две аллотропные формы - дикислород O2 и озон O3с различным числом атомов в молекулах.
Аллотропные формы элемента углерод C - алмаз и графит - отличаются строение их кристаллов.Существуют и другие причины аллотропии.
Название элемента
Аллотропные формы
Углерод С
Графит
Алмаз
Сложные вещества часто называют химическими соединениями, например оксид ртути(II) HgO (получается путем соединения атомов простых веществ - ртути Hg и кислорода O2), бромид натрия(получается путем соединения атомов простых веществ - натрия Na и брома Br2).
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также всостав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
Сравнительная характеристика смесей и химических
Вопросы для сопоставления смесей с химическими соединениями
Сопоставление
Смеси
Химические соединения
Чем отличаются по составу смеси от химических соединений?
Вещества можно смешивать в любых соотношениях, т.е. состав смесей переменный
Состав химических соединений постоянный.
Сопоставьте свойства смесей и химических соединений?
Вещества в составе смесей сохраняют свои свойства
Вещества, образующие соединения, свои свойства не сохраняют, так как образуется химическое соединений с другими свойствами
Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
Вещества можно разделить физическими способами
Химические соединения можно разложить только с помощью химических реакций
Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Механическое смешивание не сопровождается выделением теплоты или другими признаками химических реакций
Об образовании химического соединения можно судить по признакам химических реакций
II. Решите задание
Из предложенного списка веществ выпишите отдельно простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Объясните ваш выбор, в каждом из случаев.
III. Ответьте на вопросы
№1
Сколько простых веществ записано в ряду формул:
H2O, N2, O3, HNO3, P2O5, S, Fe, CO2, KOH.
№2
К сложным относятся оба вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ)и H2O (вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота) и H2 (водород).
№3
Выберите правильное утверждение:
Простые вещества состоят из атомов одного вида.
А) Верно
Б) Неверно
№4
Для смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе "смеси" не сохраняют свои индивидуальные свойства;
В) Вещества в "смесях" можно разделить физическими свойствами;
Г) Вещества в "смесях" можно разделить при помощи химической реакции.
№5
Для "химических соединений" характерно следующее:
А) Переменный состав;
Б) Вещества, в составе "химического соединения" можно разделить физическими способами;
В) Об образовании химического соединения можно судить по признакам химических реакций;
Г) Постоянный состав.
№6
В каком случае идёт речь о железе как о химическом элементе?
А) Железо - это металл, который притягивается магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7
В каком случае идёт речь о кислороде как о простом веществе?
А) Кислород - это газ, поддерживает дыхание и горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Если вы отвечаете со значком "+", к этому сообщению добавляются пользователи и им отправляется уведомление по электронной почте.
Проверка настроек доступа…
Добавить
Отмена
У вас нет прав для добавления комментариев.
Изучение строения вещества стало возможным после создания атомно-молекулярного учения. Одним из первых строение вещества стал изучать М.В. Ломоносов, применивший теорию, согласно которой все вещества включают в свой состав «корпускулы». Этим термином Ломоносов называл молекулы. Корпускулы состоят из «элементов». Этот термин Ломоносов применял для обозначения атомов. Все частицы (и атомы, и молекулы) непрерывно движутся. Молекулы простых веществ состоят из одинаковых атомов, а сложных – из различных атомов. Учение М.В. Ломоносова нашло дальнейшее развитие в работах Дж. Дальтона, который сделал первые попытки определить атомные массы известных в то время элементов. Однако он отрицал наличие молекул в простых веществах, утверждая, что простое вещество состоит лишь из одних атомов, а сложные вещества состоят из «сложных атомов».
Согласно современным представлениям, молекулы составляют парообразные и газообразные тела. В твердых телах присутствие молекул возможно только при наличии кристаллической решетки, имеющей молекулярное строение.
В атомно-молекулярном учении имеется несколько базисных утверждений: наличие между частицами определенных промежутков, размеры которых зависят от температуры и агрегатного состояния объекта. Наибольшие промежутки между молекулами наблюдаются в газообразных телах, что обуславливает их способность легко сжиматься. Значительно меньше расстояние между молекулами в жидкостях, поэтому они сжимаются труднее. Твердые тела практически не поддаются сжатию, т.к. промежутки между частицами имеют небольшой размер.
Молекулы постоянно находятся в движении. Чем выше температура тела, тем выше скорость движения. Наличие сил взаимного отталкивания и притяжения между молекулами. Молекулы состоят из атомов, находящихся в непрерывном движении. Атомов отличаются друг от друга по своим свойствам и массе. Вещества в твердом агрегатном состоянии, обладающие кристаллической решеткой, имеют в узлах этих решеток молекулы. Связи между атомами и молекулами в таких веществах слабые и разрываются при нагревании, что придает им такие физические свойства как низкая температура плавления.
Молекулы
ОПРЕДЕЛЕНИЕ
Молекула – некоторая совокупность атомов, обладающая рядом характерных отличительных свойств.
Однако свойства, которые характерны для одной молекулы, могут быть характерными и для целой группы молекул.
ОПРЕДЕЛЕНИЕ
Характерные свойства молекул – свойства, позволяющие ее идентифицировать (качественный и количественный состав, пространственное расположение атомов, энергия взаимодействие атомов, реакционная способность и др.).
Рассмотрим следующие примеры: молекулы, имеющие разный качественный состав
H 2 (водород), N 2 (азот), O 2 (кислород), F 2 (фтор), S n (сера), C (алмаз)
молекулы, имеющие одинаковый качественный, но различный количественный состав
N 2 O (оксид азота (I)), NO (оксид азота (II)), N 2 O 3 (оксид азота (III)),
NO 2 (оксид азота (IV)), N 2 O 4 (оксид азота (IV)), N 2 O 5 (оксид азота (V))
молекулы, обладающие разным качественным и количественным составом
HNO 3 (азотная кислота), CH 3 OH (метиловый спирт), SiO 2 (оксид кремния).
Структура молекулы складывается из молекулярной и электронной структур. Молекулярная структура включает типы и порядок расположения атомов молекулы в пространстве, длины связей, углы между ними, т.е. координаты всех атомов, входящих в состав молекулы. Реакционная способность – свойство молекулы вступать в химическое взаимодействие с другими молекулами. Она зависит от прочности химических связей внутри молекулы, а также её пространственного строения.
ОПРЕДЕЛЕНИЕ
Электронная структура – это информация о состоянии и характере движения электронов в молекуле (состав и вид волновых функций, описывающих движение электронов, энергия электронов, распределение электронной плотности в пределах молекулы, энергии взаимодействия отдельных атомов в молекуле и т.д.).
Молекулярная и электронная структуры связаны между собой. Информацию о молекулярной структуре получают из экспериментальных данных, а об электронной – с применением различных теорий электронного строения.
Число атомов в молекуле не ограничено, так, например молекулы газообразных веществ могут иметь в своем составе один атом (Ar), два (O 2) или более (S 8 , (C 738 H 1165 O 208 N 203 S 2 Fe) n — гемоглобин). Молекулы, содержащие повторяющиеся группы атомов общей численностью не более 100 называют олигомерами, более крупные – полимерами.
Молекула конкретного состояния не обязательно должна существовать при нормальных условиях. Так, молекулы щелочных металлов при н.у. полимерны, а при высокой температуре, в газовой фазе – двухатомны.
Объединение атомов в молекулы происходит за счет образования химических связей. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер. Для объяснения свойств химических связей используют разнообразные подходы, из которых наибольшую значимость имеют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Метод валентных связей
МВС основан на предположении о том, что химическая связь обеспечивается 2-мя электронами, движущимися в ограниченном участке электростатического поля двух ядер – концепция двухэлектронных локализованных связей. МВС позволяет понять способность атомов к образованию определенного числа ковалентных связей, дает удовлетворительное описание структуры и свойств большого числа молекул. Согласно МВС все ковалентные связи осуществляются общей парой электронов (рис. 1).
Рис. 1. Схема перекрывания 1s-электронов в молекуле водорода.
Метод молекулярных орбиталей
ММО представляет собой естественное распространение модели атома, как системы из ядра и электронных оболочек, на случай молекулы. Вся молекула рассматривается как единое целое, состоящее из ядер (вывших атомов) и электронов (ранее принадлежавших атомам. Все электроны являются общими для всех ядер, т.е. химические связи – многоцентровые, каждая связь простирается между всеми ядрами. в той или иной степени. Состояние электронов в молекуле описывается решением соответствующего уравнения Шредингера для молекулярной системы.
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение
- Семь советов от Отцов Церкви
- Унжа (Костромская область)
- Митрополит алексий московский святитель и чудотворец краткая биография Митрополит алексий годы
- Попробуем разобраться в см - Документ
- Открытия галилея в области астрономии

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter