Механизм образования химической связи. Метод валентных связей. Механизм образования связи
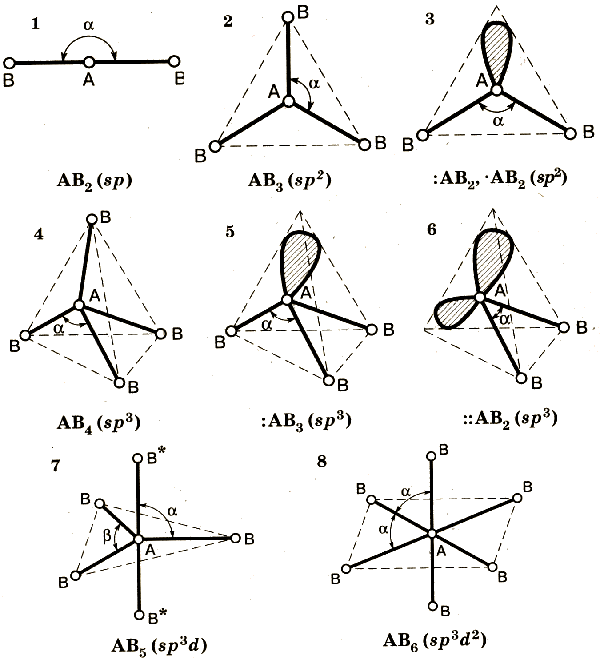
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
Гармонический осциллятор является связующей моделью, используемой для объяснения некоторых явлений, которые являются более физическими, чем химические, особенно спектроскопические свойства поглощения. Однако мы приводим его здесь, потому что это позволяет лучше интерпретировать некоторые явления.
Здесь мы символически представили вибрацию двойной связи в молекуле диоксигена. Топологические методы описания облигации - Закон. . Каждый преподаватель на стажировке должен продемонстрировать способность писать контуры. На примере атома кислорода указывается количество протонов, электронов и число валентных электронов.
- Проверьте домашнюю задачу.
- Изучение знаний студентов об атомном строительстве.
Характеристики.
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между катионами и анионами в соединении. Так, в кристалле хлорида цезия ион цезия окружают восемь ионов хлора, находящихся на кратчайшем расстоянии от него, а каждый ион хлора - восемь ионов цезия.
Химическое связывание представляет собой взаимодействие между связанными атомами, что приводит к соединению атомов. Как образуется ионная связь в молекуле хлорида натрия? Когда атом теряет или приобретает электроны, он электрически заряжен и становится ионом.
Во время реакции валентный электрон натрия переходит во внешнюю хлоровую электронную оболочку. После потери электрона атом натрия становится катионом, и атом хлора становится анионом, получая электроны. Он пропускает электроны от атома металла до атома неметалла. В результате атомы, участвующие в реакции, достигают состояния полноты валентного покрытия, получая стабильную структуру. В результате электростатического притяжения катионов натрия и анионов хлоридов образуется ионная связь.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. В расплавах ионы такую способность обретают, в результате чего расплавы ионных соединений хорошо поводят электрический ток.
Все контентные и образовательные ресурсы, опубликованные на Портале, могут использоваться его пользователями только для личного использования и для использования в школах во время занятий по дидактике. Копирование, изменение, загрузка, публичное воспроизведение и использование любого контента в коммерческих целях не допускается. Файл можно свободно обновлять для собственного использования и для использования в школах во время занятий по дидактике.
Если атомы разных элементов соединены вместе, образуется молекула химического соединения. Атомы могут сочетаться друг с другом с образованием молекул. Если атомы одного и того же элемента сливаются вместе, то образуется молекула элемента. Механизм образования ковалентных связей является результатом стремления атомов принять конфигурацию ближайшего благородного газа. Пополнение октетов в атомной связи происходит через взаимную связь электронных пар. Примером является молекула водорода, в которой дублет достигается добавлением двух электронов, полученных из двух атомов водорода.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
Атомное связывание происходит, когда неметаллические металлы связаны друг с другом. Например, каждый атом водорода имеет два электрона, которые вращаются вокруг ядер. По этой причине электронная конфигурация атомов водорода аналогична электронной конфигурации гелия. Коэффициентом связывания для двух атомов водорода является электронная пара.
Пример. Хлор-атом Хлор имеет 7 валентных электронов. Для электронной конфигурации ближайшего благородного газа ему не хватает 1 электрона. Если образование одной пары электронных электронов недостаточно для образования октета, атом может использовать два или три электрона для образования двойных связей или тройных связей. Примером может служить молекула кислорода, в которой две электронные пары образуют двойную связь.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной, которая связана с энергией взаимодействия двух заряженных частиц уравнением.
12. Металлическая связь: механизм образования, характеристики связи.
Металлическая связь – это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Здесь также образуются общие электронные пары. Характерной особенностью этой связи является сдвиг электронной пары, которая связывает атом с атомом элемента, который имеет больше протонов в ядре атома. Одним из примеров такого связывания может быть сочетание хлора и водорода в молекуле хлористого водорода.
Молекула аммиака состоит из 1 атома азота и 3 атома водорода. Водород имеет 1 валентный электрон. Для получения постоянной электронной конфигурации атом азота нуждается в 3-х электронах. В атомах водорода требуется 1 электрон. Формируются три общие электронные пары. Структурная формула. Ионное связывание - электроны, подающие электроны. Прием электронов, принимающих электроны. Хорошими донорами электронов являются элементы 1 и 2 периодической группы. Электроны валентных покрытий этих элементов слабо связаны с атомами и могут быть легко оторваны.
Механизм образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы . Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов . Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке.
Прием и пожертвование электронов изменяет заряд атомов. Каждый атом является электрически нейтральным до подачи или приема электронов. Когда валентные электроны удаляются, заряд оставшихся электронов больше не уравновешивает положительный заряд ядра. Поскольку электрон имеет единичный отрицательный заряд, удаление одного электрона из нейтрального атома приводит к образованию катиона положительного заряда. Каждый электрон, потерянный атомом, увеличивает общий положительный заряд атома на единицу. Атомы 17 групп легко подбирают электроны.
Характеристики. Для всех металлов характерны электро- и теплопроводность, пластичность, металлический блеск, обычно серый цвет и непрозрачность.
13. Ковалентная связь: механизм образования, характеристики связи.
КОВАЛЕНТНАЯ СВЯЗЬ - химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам.
Виды :
· неполярная
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н 2 , Сl 2 , О 2 , N 2 , F 2 и др., в которых электронная пара в одинаковой мере принадлежит обоим атомам.
· полярная
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: НСl, Н 2 О, Н 2 S, NН 3 и др.
механизм образования ковалентной связи .
· Обменный - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
· Донорно-акцепторный - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора.
Характеристики
· Насыщаемость – определяет стехиометрию (количественный состав) молекулярных химических соединений.
Это свойство заключается в том, что каждый атом может присоединить только определенное число других атомов. Так, как правило, простые газообразные вещества состоят из 2 атомов: О 2 , Сl 2 , N 2 и т.д.
· Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков.
Различают следующие формы молекул:
· линейную – НСl, H 2 , Cl 2 , BeCl 2 , ZnCl 2 и т.д.;
· угловую – Н 2 О, Н 2 S;
· пирамидальную – NH 3 , PH 3 ;
· треугольную – BCI 3 , AICI 3 (плоскость);
· тетраэдрическую – SiCI 4 , CCI 4 , CH 4 .
· Полярность связи
В двухатомных молекулах простых веществ (Н 2 , О 2 , Cl 2 и т.д.) электронные пары, образующие ковалентные связи, в равной степени принадлежат обоим атомам и, следовательно, находятся посередине между их центрами, т.е. общее электронное облако симметрично. Связь в этом случае называется неполярной(гомеополярной) .
14. Гибридизация атомных орбиталей.
Гибридизация орбиталей - гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы нету с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
ТИПЫ ГИБРИДИЗАЦИИ
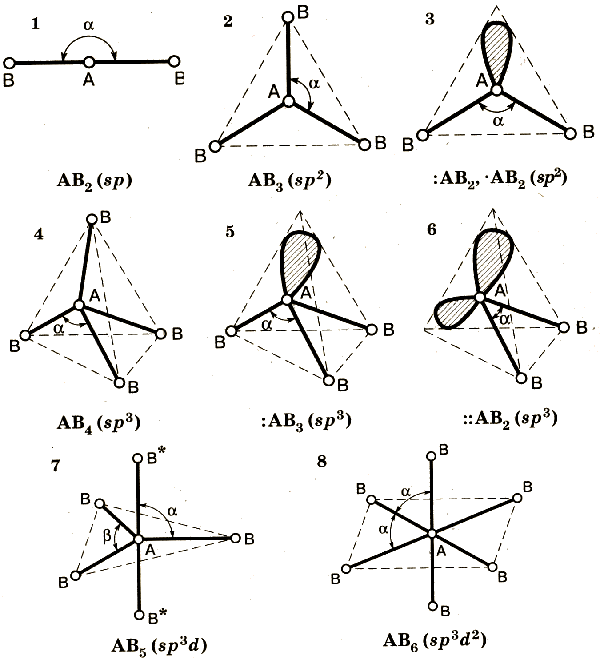
15. Структура комплексных соединений. Диссоциация комплексных соединений. Константа диссоциации комплексных соединений.
Комплексные соединения - частицы образованные положительно заряженными ионами металлов могут находиться в окружении анионов или нейтральных молекул.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Насыщаемость
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Валентность - свойство атома данного элемента присоединять или замещать определённое число атомов другого элемента. Мерой валентности является число ковалентных связей, которые образует атом. При этом учитывают связи, образованные как по обменному механизму, так и по донорно-акцепторному.
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов по одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода:
Н∙ + ∙Н = Н׃Н
При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличится в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние стабилизируется. Это возможно при переходе электронов на более высокие подуровни внутри одного и того же энергетического уровня.
Валентности атомов:Li(1s 2 2s 1 2p 0),N(1s 2 2s 2 2p x 1 2p y 1 2p z 1),O(1s 2 2s 2 2p x 2 p y 1 p z 1),
F(1s 2 2s 2 p 5),Ne(1s 2 2s 2 2p 6) равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электронов на новый, более высокий энергетический уровень.
Таким образом, валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0.
В атомах бериллия, бора, углерода может происходить разделение электронных пар за счёт перехода электронов с 2s- подуровня на 2p-подуровень, так как в атомах этих элементов на 2p- подуровне имеются вакантные орбитали. Поэтому валентности 2,3 и 4, присущие атомам Ве,В,С в возбуждённом состоянии, более характерны для них, чем валентности, определяемые числом неспаренных электронов в основном состоянии.
Число химических связей, которые атом образует по донорно-акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три- за счёт трёх неспаренных электронов и ещё одну – за счёт электронной пары.
Направленность связи
Преимущественно ковалентные связи являются направленными. Направленность связей характеризуется углами между связями(валентными углами).Любые ковалентные соединения имеют строго определённые углы между связями. Различные экспериментальные методы нахождения валентных углов дают очень близкие значения. Углы между преимущественно ковалентными связями и длины связей определяют строение многоатомных молекул и ионов их структуру.
Длина и энергия связи
Энергия связи - это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н 2 содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.
Для двухатомных молекул энергия связи равна энергии диссоциации. Для многоатомных молекул с одним типом связи средняя энергия связи равна 1/n части распада молекулы на атомы. Энергия распада метана на атомы равна 1649 кДж/моль. В молекуле метана имеются четыре равноценные связи С-Н поэтому средняя энергия такой связи равна Ес-н = 1649/4 = 412 кДж/моль.
Длина связи
Длина химической связи - среднее расстояние между ядрами атомов, образующих химическую связь.
В ряду однотипных молекул длины связей изменяются закономерно. Например, в ряду HF, HCl, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна(в пм): 91; 127; 141; 161. Энергия связи(Е кДж/моль) в этом ряду закономерно уменьшается: 565,7; 427,8; 362,5; 294,5. На длину связи влияет её кратность. Повышение кратности связи приводит к упрочнению межатомной связи и уменьшению длины связи. Так, длина связи в молекуле фтора (F–F) равна 141 пм,а энергия связи 159,0 кДж/моль; длина связи в молекуле азота с тройной связью (N≡N) равна 110пм, а энергия связи 941,6 кДж/моль
(см. табл.2 Приложения).
Полярность связи
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Между разными атомами чистая ковалентная связь может проявляться, если электроотрицательность (ЭО) атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными (например, двухатомные молекулыH 2 , Cl 2 , N 2).Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО. Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние l. Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной. Например, в молекуле HCl связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Таким образом, атом водорода в хлороводороде поляризован положительно, а атом хлора отрицательно.
На атоме водорода возникает положительный заряд δ= +0,18, а атоме хлора - отрицательный δ= – 018. Следовательно, связь в молекуле хлороводорода имеет на 18% ионный характер.
Полярная связь - разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом µ, представляющим собой произведение величины элементарного электрического заряда q на длину диполя (l), т.е. µ = q∙l . Дипольные моменты измеряют в кулонометрах
(см. табл. 3 Приложения).
Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному. Результат сложеиия зависит от структуры молекулы. Дипольный моиент высокосимметричных молекул BeCl 2 , BF 3 , CCl 4 равен нулю, хотя связи Be – Cl, B– F, C–Cl имеют сильно полярный характер. В угловой молекуле Н 2 О полярные связи О–Н расположены под углом 104,5 о. Поэтому молекула оказывается полярной
(µ = 0,61∙10 -29 Кл∙м)
При очень большой разности электроотрицательности у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей электроотрицательностью, атомы переходят в противоположно заряженные ионы и возникает ионная молекула. Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает.
Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%.
Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF 2 , CF 4 , NF 3 , OF 2 , F 2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора.
Электроотрицательность серы значительно меньше, чем ЭО кислорода. Поэтому полярность связи H –S в H 2 S меньше полярности связи Н–О в Н 2 О, а длина связи H–S (135 пм) больше, чем Н–О (96 пм) и угол между связями приближается к прямому. Для H 2 S он составляет 92 о, а для H 2 Se – 91 o .
По этим же причинам молекула аммиака имеет пирамидальное строение и угол между валентными связями H–N–H больше прямого (107,3 о). При переходе от NH 3 к PH 3 , AsH 3 и SbH 3 углы между связями составляют соответственно 93,3 о; 91,8 о и 91,3 о.
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter