В главных подгруппах a группах периодической системе. Периодический закон Д. И. Mенделеева. Взаимосвязь элементов. IV.1. Тантал в свободном состоянии
Понятие об элементах как о первичных веществах етришло из глубокой древности и, постепенно видоизменяясь а уточняясь, дошло до нашего времени. Основоположникам научных воззрений на химические элементы являются Р. Бойль (VII в.), М. В. Ломоносов (XVIII в.) и Дальтон (XIX в.).
К началу XIX в. было известно около 30 элементов, к середине XIX в.- около 60. По море накопления числа элементов возникла задача их систематизации. Таких попыток до Д.И. Менделеева было не меньше пятидесяти; за основу систематизации принимались: и атомный вес (ныне называемый атомной массой), и химический эквивалент, и валентность. Подходя к классификации химических элементов метафизически, пытаясь систематизировать только известные в то время элементы, ни один из предшественников Д. И. Менделеева не мог открыть всеобщую взаимосвязь элементов, создать единую стройную систему, отражающую закон развития материи. Эта важная, для науки задача была блестяще разрешена в 1869 г. великим русским ученым Д. И. Менделеевым, открывшим периодический закон.
За основу систематизации Менделеевым были взяты: а) атомный вес и б) химическое сходство между элементами. Наиболее ярким, выразителем сходства свойств элементов является их одинаковая высшая валентность. Как атомный вес (атомная масса), так и высшая валентность элемента представляют собой количественные, числовые константы, удобные для систематизации.
Расположив все известный в то время 63 элемента в ряд по возрастанию атомных масс, Менделеев заметил периодическую повторяемость свойств элементов через неодинаковые промежутки. В результате Менделеевым был создан первый вариант периодической системы.
Закономерный характер изменения атомных масс элементов по вертикалям и горизонталям таблицы, а также образовавшиеся в ней пустые мecта позволили Менделееву смело предсказать наличие n природе ряда элементов, еще не известных в то время науке и даже наметить их атомные массы и основные свойства, исходя из предполагаемого положения элементов в таблице. Это можно било сделать лишь на основе системы, объективно отражающей закон развития материи. Сущность периодического закона Д. И. Менделеев сформулировал в 1869 г.: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов".
IV.4. Применение тантала и ниобия
Неметаллы находятся в правой части периодической таблицы и являются элементами с наивысшими значениями электроотрицательности. Они могут иметь разные состояния материи; некоторые из них твердые, газообразные или жидкие. Они не проводят электричество, в отличие от металлов.
Все элементы, которые действуют как «разделительная стена» между металлами и неметаллами, являются частью металлоидов. Эти элементы имеют характеристики, общие для металлов, но обладают химическими свойствами, которые нельзя комбинировать с неметаллами.
Периодическая система элементов.
В 1871 году Д. И. Менделеев дает второй вариант периодической системы (так называемую короткую форму таблицы), в которой он выявляет различные степени родства между элементами. Этот вариант системы дал возможность Менделееву предсказать существование 12 элементов и свойства трех из них описать с очень большой точностью. В период с 1875 по 1886 гг. эти три элемента были открыты и выявилось полное совпадение их свойств с теми, которые были предсказаны великим русским ученым. Эти элементы получили следующие названия: скандий, галлий, германий. После этого периодический закон полечил всеобщее признание как объективный закон природы и ныне является фундаментом химии, физики и других естественных наук.
Периодическая система химических элементов - это графическое выражение периодического закона. Известно, что ряд законов, кроме словесных формулировок, можно изображать графически и выражать математическими формулами. Таков и периодический закон; только присущие ему математические закономерности, о которых будет сказано ниже, не объединены еще общей формулой. Знание периодической системы облегчает изучение курса общей химии.
Конструкция современной периодической системы в принципе мало отличается от варианта 1871 г. Символы элементов в периодической системе расположены по вертикальным и горизонтальным графам. Это приводит к объединению элементов в группы, подгруппы, периоды. Каждый элемент занимает в таблице определенную клетку. Вертикальные графы – это группы (и подгруппы), горизонтальные – периоды (и ряды).
Группой
называется совокупность элементов с одинаковой валентностью по кислороду. Эта высшая валентность определяется номером группы. Так как сумма высших валентностей по кислороду н водороду для элементов-неметаллов равна восьми, то по номеру группы легко определить и формулу высшего водородного соединения. Так, для фосфора - элемента пятой группы - высшая валентность по кислороду равна пяти, формула высшего окисла Р2О5, а формула соединения с водородом - РН3. Для серы - элемента шестой группы - формула высшего окисла - SO3, а высшего соединения с водородом - H2S.
Некоторые элементы имеют высшую валентность, не равную номеру их групп. Такими исключениями являются медь Сu, серебро Ag, золото Аu. Они находятся в первой группе, однако их валентности изменяются от одного до трех. Например, имеются соединения: CuO; AgO; Cu2O3; Au2О3. Кислород поставлен в шестую группу, хотя соединения его с валентностью выше двух почти не встречаются. Фтор Р - элемент VII группы - в своих важнейших соединениях одновалентен; бром Вr -элемент VII группы - максимально пятивалентен. Особенно много исключений в VIII группе. В ней только два элемента: рутений Ru и осмий Os проявляют валентность, равную восьми, их высшие окислы имеют формулы RuO4 и OsO4 Валентность же остальных элементов VIII группы значительно ниже.
Первоначально периодическая система Менделеева состояла из восьми групп. В конце XIX в. были открыты инертные элементы, предсказанные русским ученым Н. А. Морозовым, и периодическая система была пополнена девятой по счету группой - нулевой по номеру. Теперь многие ученые считают нужным возвратиться к делению всех элементов снова на 8 групп. Это делает систему более стройной; с позиций октета (восьми) групп яснее становятся некоторые правила и законы.
Элементы группы распределяются по подгруппам
. Подгруппа объединяет элементы данной группы, более сходные по своим химическим свойствам. Сходство это зависит от аналогии в строении электронных оболочек атомов элементов. В периодической системе символы элементов каждой из подгрупп располагают строго по вертикали.
В первых семи группах имеется по одной главной и по одной побочной подгруппе; в восьмой группе имеется одна главная подгруппа, «инертные» элементы, и три побочных. Наименование каждой подгруппы обычно дается по названию верхнего элемента, например: подгруппа лития (Li-Na-K-Rb-Cs-Fr), подгруппа хрома (Cr-Mo-W).В то время как элементы одной и той же подгруппы являются химическими аналогам, элементы разных подгрупп одной и той же группы иногда очень резко отличаются по своим свойствам. Общим свойством для элементов главной и побочной подгрупп одной и, той же группы является в основном только одинаковая их высшая валентность по кислороду. Так, марганец Мn и хлор С1, находящиеся в разных подгруппах VII группы, химически не имеют почти ничего общего: марганец - металл, хлор - типичный неметалл. Однако формулы их высших оксидов и отвечающие им гидроокиси аналогичны: Мn2О7 - Cl2O7; НМnО4 - НС1О4.
В периодической системе имеются два горизонтальных ряда по 14 элементов, расположенных вне групп. Обычно их помещают внизу таблицы. Один из этих рядов составляют элементы, названные лантаноидами (буквально: подобные лантану), другой ряд - элементы актиноиды (подобные актинию). Символы актиноидов расположены под символами лантаноидов. Этим расположением выявляются 14 более коротких подгрупп, состоящих из 2 элементов каждая: это вторые побочные, или лантаноидно-актиноидные подгруппы.
На основе всего сказанного различают: а) главные подгруппы, б) побочные подгруппы и в) вторые побочные (лантаноидно-актиноидные) подгруппы.
Следует учесть, что некоторые главные подгруппы также отличаются друг от друга по строению атомов их элементов. Исходя из этого, все подгруппы периодической системы можно разделить на 4 категории
.
I. Главные подгруппы I и II групп (подгруппы лития и бериллия).
II. Шесть главных подгрупп III - IV - V - VI - VII - VIII групп (подгруппы бора, углерода, азота, кислорода, фтора и неона).
III. Десять побочных подгрупп (по одной в I - VII группах и три в VIII группе). Jfc,
IV. Четырнадцать лантаноидно-актиноидных подгрупп.
Количества подгрупп этих 4-х категорий составляют арифметическую прогрессию: 2-6-10-14.
Следует отметить, что верхней элемент любой главной подгруппы находится во 2 периоде; верхний элемент любой побочной - в 4 периоде; верхний элемент любой лантаноидно-актиноидной подгруппы - в 6 периоде. Таким образом, с каждым новым четным периодом периодической системы появляются новые категории подгрупп.
Каждый элемент, кроме нахождения в той или иной группе и подгруппе, находится, еще в одном из семи периодов.
Периодом называется такая последовательность элементов, на протяжении которой свойства их изменяются в порядке постепенного усиления от типично металлических до типично неметаллических (металлоидных). Заканчивается каждый период инертным элементом. По мере ослабления металлических свойств у элементов начинают появляться и постепенно усиливаются неметаллические свойства; в середине периодов находятся обычно элементы, совмещающие в той или иной степени как металлические, так и неметаллические свойства. Эти элементы часто называют амфотерными.
Состав периодов.
Периоды не равномерны по числу входящих в них элементов. Первые три называются малыми, остальные четыре - большими. На рис. 8 изображен состав периодов. Число элементов в любом периоде выражается формулой 2п2 где n - целое число. Во 2 и 3 периодах находится по 8 элементов; в 4 и 5 - по 18 элементов; в 6-32 элемента; в 7, еще не законченном, пока 18, элементов, хотя теоретически должно быть тоже 32 элемента.
Оригинален 1 период. В нем только два элемента: водород Н и гелий Не. Переход свойств от металлических до неметаллических совершается:здесь в одном типично амфотерном элементе - водороде. Последний по присущим ему некоторым металлическим свойствам возглавляет подгруппу щелочных металлов, по присущим же ему неметаллическим свойствам - подгруппу галогенов. Водород поэтому часто помещают в периодической системе дважды - в 1 и VII группах.
Различный количественный состав периодов приводит к важному следствию: соседние элементы малых периодов, например углерод С и азот N сравнительно резко отличаются друг от друга по своим свойствам: соседние же элементы больших периодов, например, свинец Pb и висмут Bi, значительно ближе по свойствам друг к другу, так как изменение характера элементов в больших периодах происходит малыми скачками. На отдельных участках больших периодов наблюдается даже столь медленный спад металличности, что рядом стоящие элементы оказываются весьма сходными по своим химический свойствам. Такова, например, триада элементов четвертого периода: железо Fe – кобальт Со – никель Ni, которую часто называют «семейством железа». Сходство по горизонтали (горизонтальная аналогия) перекрывает здесь даже сходство по вертикали (вертикальную аналогию); так, элементы подгруппы железа - железо, рутений, осмий-менее химически сходны между собой, чем элементы «семейства железа».
Наиболее ярким примером горизонтальной аналогии являются.лантаноиды. Все они химически сходны между собой и с лантаном La. В природе они встречаются компаниями, трудно разделяются, типичная высшая валентность большинства их равна 3. У лантаноидов обнаружена особая внутренняя периодичность: каждый восьмой из них по порядку расположения повторяет в некоторой степени свойства и валентные состояния первого, т.е. того из них, от которого начинается отсчет. Так, тербий Тb похож на церий Се; лютеций Lu - на гадолиний Gd.
Актиноиды сходны с лантаноидами, однако горизонтальная аналогия у них проявляется в значительно меньшей степени. Высшая валентность некоторых актиноидов (например, урана U) достигает шести. Принципиально возможная и среди них внутренняя периодичность пока еще не подтверждена.
Расположение элементов в периодической системе. Закон Мозли.
Д. И. Менделеев расположил элементы в определенной последовательности, называемой иногда „Менделеевским рядом". В целом эта последовательность (нумерация) связана с возрастанием атомных масс элементов. Однако имеются и исключения. Иногда логичный ход изменения валентности находится в противоречии с ходом изменения атомных масс. В таких случаях необходимость требовала отдать предпочтение какой-либо одной из этих двух основ систематизации. Д. И. Менделеев в отдельных случаях нарушал принцип расположения элементов но возрастающим атомным массам и опирался на химическую аналогию между элементами. Если бы Менделеев поместил никель Ni перед кобальтом Со, йод I перед теллуром Те, то эти элементы попали бы в подгруппы и группы, не соответствующие, их свойствам, и их высшей валентности.
В 1913 г. английский ученый Г. Мозли, исследуя спектры лучей Рентгена для различных элементов, подметил закономерность, связывающую номера элементов в периодической системе Менделеева с длиной волн этих лучей, получившихся в результате облучения тех или иных элементов катодными тучами. Оказалось, что квадратные корни из обратных значений длин волн этих лучей связаны линейной зависимостью с порядковыми номерами соответствующих элементов. Закон Г. Мозли позволил проверить правильность „Менделеевского ряда" и подтвердил его безупречности.
Пусть, например, известны значения для элементов № 20 и №30, номера которых в системе сомнений у нас не вызывают. Эти значения связаны с указанными номерами линейной зависимостью. Для проверки, например, правильности номера, присвоенного кобальту (27), и судя по атомной массе, этот номер должен был бы иметь никель, его облучают катодными лучами: в результате из кобальта выделяются лучи Рентгена. Разложением их на подходящих дифракционных решетках (на кристаллах) получаем спектр этих лучей и, выбрав наиболее четкую из спектральных линий, измеряем длину волны () луча, соответствующего этой линии; затем откладываем на ординате значение . Из полученной точки А проводим прямую, параллельную оси абсцисс, до пересечения с выявленной ранее прямой. Из точки пересечения Б опускаем перпендикуляр на ось абсцисс: он точно укажет нам номер кобальта, равный 27. Так, периодическая система элементов Д. И. Менделеева - плод логических умозаключений ученого - получила экспериментальное подтверждение.
Современная формулировка периодического закона. Физический смысл порядкового номера элемента.
После работ Г. Мозли атомная масса элемента постепенно начала уступать свою первенствующую роль новой, еще не ясной по своему внутреннему (физическому) смыслу, но более четкой константе - порядковому или, как теперь называют, атомному номеру элемента. Физический смысл этой константы был выявлен в 1920 г. работами английского ученого Д.Чедвика. Д. Чёдвик экспериментально установил, что порядковый номер элемента численно равен величине положительного заряда Z ядра атома этого элемента, т. е. количеству протонов в ядре. Оказалось, что Д. И. Менделеев, сам того не подозревая, расставил элементы в последовательности, точно соответствующей возрастанию заряда ядер их атомов.
К этому же времени было также установлено, что атомы одного и того же элемента могут отличаться друг от друга своей массой; такие атомы получили название изотопов. Примером могут служить атомы: и . В периодической системе изотопы одного и того же элемента занимают одну клетку. В связи с открытием изотопов было уточнено понятие химический элемент. В настоящее время химическим элементом называют вид атомов, имеющих одинаковый заряд ядра - одинаковое количество протонов в ядре. Была уточнена и формулировка периодического закона. Современная формулировка закона гласит: свойства элементов и их соединений находятся в периодической зависимости от величины, заряда ядер их атомов.
Периодически изменяются и другие характеристики элементов, связанные со строением внешних электронных слоев атомов, атомные объемы, энергия ионизации и другие свойства.
Периодическая система и строение электронных оболочек атомов элементов.
В дальнейшем было установлено, что не только порядковый номер элемента имеет глубокий физический смысл, но и другие понятия, ранее рассмотренные ранее также постепенно приобретали физический смысл. Например, номер группы, указывая на высшую валентность элемента, выявляет тем самым максимальное число электронов атома того или иного элемента, которое может участвовать в образовании химической связи.
Номер периода, в свою очередь, оказался связанным с числом энергетических уровней, имеющихся в электронной оболочке атома элемента данного периода.
Таким образом, например, „координаты" олова Sn (порядковый номер 50, 5 период, главная подгруппа IV группы), означают, что электронов в атоме олова 50, распределены они на 5 энергетических уровнях, валентными являются лишь 4 электрона.
Физический смысл нахождения элементов в подгруппах различных категорий чрезвычайно важен. Оказывается, что у элементов, расположенных в подгруппах I категории, очередной (последний) электрон располагается на s-подуровне внешнего уровня. Эти элементы относят к электронному семейству. У атомов элементов, расположенных в подгруппах II категории, очередной электрон располагается на р-подуровне внешнего уровня. Это, элементы электронного семейства „р". Так, очередной 50-й электрон у атомов олова располагается на р-подуровне внешнего, т. е. 5-го энергетического уровня.
У атомов элементов подгрупп III категории очередной электрон располагается на d-подуровне, но уже пред внешнего уровня, это элементы электронного семейства «d». У атомов лантаноидов и актиноидов очередной электрон располагается на f-подуровне, пред пред внешнего уровня. Это элементы электронного семейства «f».
Не случайно, следовательно, отмеченные выше числа подгрупп этих 4-х категорий, то есть 2-6-10-14, совпадают с максимальными числами электронов на подуровнях s-p-d-f.
Но можно, оказывается, решить вопрос о порядке заполнения электронной оболочки и вывести электронную формулу для атома любого элемента и на основе периодической системы, которая с достаточной ясностью указывает уровень и подуровень каждого очередного электрона. Периодическая система указывает и на размещение одного за другим элементов по периодам, группам, подгруппам и на распределение их электронов по уровням и подуровням, потому что каждому элементу соответствует свой собственный, характеризующий его последний электрон. В качестве примера разберем составление электронной формулы для атома элемента циркония (Zr). Периодическая система дает показатели и „координаты" этого элемента: порядковый номер 40, период 5, группа IV, побочная подгруппа. Первые выводы: а) всех электронов 40, б) эти 40 электронов распределены на пяти энергетических уровнях; в) из 40 электронов только 4 являются валентными, г) очередной 40-й электрон поступил на d-подуровень пред внешнего, т. е. четвертого энергетического уровня. Подобные выводы можно сделать о каждом из 39 элементов, предшествующих цирконию, только показатели и координаты будут каждый раз иными.
Поэтому методический прием составления электронных формул элементов на основе периодической системы и состоит в том, что мы последовательно рассматриваем электронные оболочка каждого элемента по пути к заданному, выявляя по его «координатам", куда направился в оболочке его очередной электрон.
Первые два элемента первого периода водород Н и гелий Не относятся к s-семейству. Их электроны в числе двух поступают на s-подуровень первого уровня. Записываем: Певый период на этом заканчивается, первый энергетический уровень также. Следующие по порядку два элемента второго периода - литий Li и бериллий Be находятся в главных подгруппах I и II групп. Это также s-элементы. Их очередные электроны расположатся на s подуровне 2-го уровня. Записываем Далее следуют подряд 6 элементов 2-го периода: бор В, углерод С, азот N, кислород О, фтор F и неон Ne. Согласно местонахождению этих элементов в главных подгруппах Ш - Vl групп их очередные электроны в числе шести будут располагаться на р-подуровне 2-го уровня. Записываем: Инертным элементом неоном второй период заканчивается, второй энергетический уровень также закончен. Далее следуют два элемента третьего периода главных подгрупп I и II групп: натрий Na и магний Mg. Это s-элементы и их очередные электроны располагаются на s-подуровне 3-го уровня Затем идут шесть элементов 3-го периода: алюминий Аl, кремний Si, фосфор Р, сера S, хлор С1, аргон Аr. Согласно нахождению этих элементов в главных подгруппах III - УI групп их очередные электроны в числе шести расположатся на р-подуровне 3-го уровня - Инертным элементом аргоном 3-й период закончен, но 3-й энергетический уровень еще не закончен, пока отсутствуют электроны на его третьем возможном d-подуровне.
Далее следуют 2 элемента 4-го периода главных подгрупп I и II групп: калий К и кальций Са. Это снова s-элементы. Их очередные электроны будут находиться на s-подуровне, но уже 4-го уровня. Этим очередным электронам энергетически выгоднее начать заполнять более удаленный от ядра 4-й уровень, нежели заполнять подуровень 3d. Записываем: Десять следующих элементов 4-го периода от № 21 скандия Sc до № 30 цинка Zn находятся в побочных подгруппах III - V - VI - VII - VIII - I - II групп. Так как все они являются d-элементами, то их очередные электроны располагаются на d-подуровне пред внешнего уровня т. е. третьего от ядра. Записываем:
Следующие шесть элементов 4-го периода: галлий Ga, германий Ge, мышьяк As, селен Se, бром Вr, криптон Кr - находятся в главных подгруппах III - VIIJ групп. Их очередные 6 электронов располагаются на р-подуровне внешнего, т. е. 4-го уровня: Рассмотрены 3б элементов; четвертый период закончен инертным элементом криптоном; закончен и 3-й энергетический уровень. Однако на 4 уровне полностью заполнены лишь два подуровня: s и р (из 4-х. возможных).
Далее следуют 2 элемента 5-го периода главных подгрупп I и II групп: № 37 рубидий Rb и № 38 стронций Sr. Это элементы s-семейства, и их очередные электроны располагаются на s-подуровне 5-го уровня: Последние 2 элемента - № 39 иттрий YU № 40 цирконий Zr - находятся уже в побочных подгруппах, т. е. принадлежат к d-семейству. Два их очередных электрона направятся на, d-подуровень, пред внешнего, т.е. 4-го уровня Суммируя последовательно все записи, составляем электронную формулу для атома циркония № 40 Выведенную электронную формулу для атома циркония можно несколько видоизменить, расположив подуровни в порядке нумерации их уровней:
Выведенную формулу можно, разумеется, и упростить, в распределение электронов лишь по энергетическим уровням: Zr – 2|8| 18 |8 + 2| 2 (стрелкой указано место вступления очередного электрона; подчеркнуты валентные электроны). Физический смысл категории подгрупп заключается не только в различии места вступления очередного электрона в оболочку атома, но и в том, на каких уровнях расположены валентные электроны. Из сопоставления упрощенных электронных формул, например, хлора (3-й период, главная подгруппа VII группы), циркония (5-й период, побочная подгруппа IV группы) и урана (7-й период, подгруппа лантаноидно-актиноидная)
№17, С1-2|8|7
№40, Zr - 2|8|18|8+ 2| 2
№92, U - 2|8|18 | 32 |18 + 3|8 + 1|2
видно, что у элементов любой главной подгруппы валентными могут быть лишь электроны внешнего уровня (s и р). У элементов побочных подгрупп валентными могут быть электроны внешнего и частично пред внешнего уровня (s и d). У лантаноидов и особенно актиноидов валентные электроны могут находиться на трех уровнях: внешнем, пред внешнем и пред пред внешнем. Как правило, общее число валентных электронов равно номеру группы.
Свойства элементов. Энергия ионизации. Энергия сродства к электрону.
Сравнительное рассмотрение свойств элементов осуществляется по трем возможным направлениям периодической системы: а) горизонтальному (по периоду), б) вертикальному (по подгруппе), в) диагональному. Для упрощения рассуждений исключим 1-й период, незаконченный 7-й, а также всю VIII группу. Останется основной параллелограмм системы, в верхнем левом углу которого будет находится литий Li (№3), в нижнем левом – цезий Сs (№55). В правом верхнем – фтор F (№9), в правом нижнем – астат Аt (№85).
направлениям. По горизонтальному направлению слева направо объемы, атомов постепенно уменьшаются; происходит, это в результате влияния увеличения заряда ядра на электронную оболочку. По вертикальному направлению сверху вниз в результате увеличения числа уровней объемы атомов постепенно возрастают; по диагональному направлению - значительно менее отчетливо выраженному и более короткому - остаются близкими. Это общие закономерности, из которых, как всегда, имеются и исключения.
В главных подгруппах по мере увеличения объемов атомов, т. е. сверху вниз, облегчается отщепление внешних электронов и затрудняется присоединение к атомам новых электронов. Отдача электронов характеризует так называемую восстановительную способность элементов, особенно типичную для металлов. Присоединение же электронов характеризует окислительную способность, - типичную для неметаллов. Следовательно, сверху вниз в главных подгруппах восстановительная способность атомов элементов возрастает; увеличиваются и металлические свойства простых тел, соответствующих этим элементам. Окислительная же способность уменьшается.
Слева направо по периодам картина изменений противоположная: восстановительная способность атомов элементов уменьшается, окислительная же - увеличивается; увеличиваются неметаллические свойства простых тел, соответствующих этим элементам.
По диагональному направлению свойства элементов остается более или менее близкими. Рассмотрим это направление на примере: бериллий-алюминий 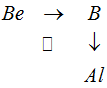 От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
Таким образом, между периодической системой, строением атомов элементов и их химическими свойствами существует тесная связь.
Свойства атома любого элемента - отдавать электрон и превращаться в положительно заряженный ион - оцениваются количественно затратой энергии, называемой энергией ионизации I*. Ее выражают в ккал/г-атом или хдж/г-атом.
![]()
Чем меньше эта энергия, тем атом элемента сильнее проявляет восстановительные свойства, тем элемент металличнее; чем больше этa энергия, тем металлические свойства слабее, тем сильнее у элемента проявляются неметаллические свойства. Свойство атома любого элемента принимать электрон и превращаться при этом в отрицательно заряженный ион оценивается количеством выделяющейся энергии, называемой энергичней сродства к электрону Е; ее также выражают в ккал/г-атом или кдж/г-атом.
![]()
Сродство к электрону может служить мерой способности элемента проявлять неметаллические свойства. Чем больше эта энергия, тем элемент неметалличнее, и, наоборот, чем энергия меньше, тем элемент металличнее.
Часто для характеристики свойств элементов используют величину, которая называется электроотрицательностью .
Она: представляет собой арифметическую сумму величин энергии ионизации и энергии сродства к электрону
Константа является мерой неметалличности элементов. Чем она больше, тем сильнее элемент проявляет неметаллические свойства.
Следует учитывать, что все элементы по сути дела двойственны по природе. Деление элементов на металлы и неметаллы до известной степени условно, ибо в природе нет резких граней. С усилением у элемента металлических свойств происходит ослабление его неметаглических свойств и наоборот. Самый „металличный" из элементов - франций Fr - можно считать наименее неметалличным, самый „неметалличный" - фтор F - можно считать наименее металличным.
Суммируя значения вычисленных энергий - энергии ионизации и энергии сродства к электрону, - мы получим: для цезия величину 90 ккал/г-а., для лития 128 ккал\г-а., для фтора = 510 ккал1г-а. (величину выражают и в кдж/г-а.). Это - абсолютные значения электроотрицательности. Для упрощения пользуются относительными значениями электроотрицательности, принимая электроотрицательность лития (128) за единицу. Тогда для фтора (F) получим:

Для цезия (Cs) относительная электроотрицательность будет равна
На графике изменения электроотрицательности элементов главных подгрупп
I-VII групп. сопоставлены электроотрицательности элементов главных подгрупп I-VII групп. Приведенные данные указывают на истинное положение водорода в 1-ом периоде; неодинаковое возрастание металличности элементов, сверху вниз по различным подгруппам; некоторое сходство элементов: водорода - фосфора - теллура ( = 2,1), бериллия и алюминия (=1,5) и ряда других элементов. Как видно из приведенных сопоставлений, используя значения электроотрицательности, можно приближенно сравнивать между собой, элементы даже разных подгрупп, и разных периодов.

График изменения эдектроотрицательностн элементов главных подгрупп I-VII групп.
Периодический закон и периодическая система элементов имеют огромное философское, научное и методологическое значения. Они являются: средством познания окружающего нас мира. Периодический закон вскрывает и отражает диалектико-материалистическую сущность природы. Периодический, закон и периодическая система элементов со всей убедительностью доказывают единство и материальность окружающего нас мира. Они являются лучшим подтверждением справедливости основных черт марксистского диалектического метода познания: а) взаимосвязи и взаимозависимости предметов и явлений, б) непрерывности движения и развития, в) перехода количественных изменений в качественные, г) борьбы и единства противоположностей.
Огромное научное значение периодического закона заключается в том, что он помогает творческим открытиям в области химических, физических, минералогических, геологических, технических и других наук. До открытия периодического закона химия представляла собой скопление разрозненных, лишенных внутренней связи фактических сведений; теперь все это приведено в единую стройную систему. Многие открытия в области химии и физики были сделаны на основе периодического закона и периодической системы элементов. Периодический закон открыл путь к познанию внутреннего строения атома и его ядра. Он обогащается все новыми открытиями и подтверждается как незыблемый, объективный закон природы. Большое методологическое и методическое значение периодического закона и периодической системы элементов заключается в том, что при изучении химии они дают возможность развивать у студента диалектико-материалистическое мировоззрение и облегчают усвоение курса химии: Изучение химии следует строить не на запоминании свойств отдельных элементов и их соединений, а судить о свойствах простых и сложных веществ, исходя из закономерностей, выраженных периодическим законом и периодической системой элементов.
Проглядев новый элемент в бурой свинцовой руде, и прав был Берцелиус, когда о не без ирони смеялся над тем, как неудачно слабо, без упорства, стучался я в дом богини Ванадис» .
Через год в 1802 г. шведский химик Андерс Густав Экеберг обнаружил в одной из финляндск х руд новый х имический элемент. А. Экеберг не знал об открытии Ч. Хатчета и поэтому новому элементу дал наименов ние «тантал», а руда стала на ываться танталитом. Сходство тантал и колумбия и их соед нений между собой было так велико (с точки зрения тогдашних химиков), что свыше сорока лет подавляющее большинство химиков считало: Колумби и тантал-один и тот же элемент.
За этим элементом прочно закрепилось назван е «тантал». По одом к такому названию послужило необычное для металлического оксида свойство: он не способ н «насыщаться» - образовывать сол с кис отам .
Сильно меняющаяся от образца к образцу плотность окс да тантала заставила предположить присутствие в ней какого то другого элемента, очень похожего на тантал, а потому трудно отделимого от него. Поэтому, когд а в 1844 г. Г. Розе сследовал обра цы колумбита, найд н ые в Баварии, он вновь столкнулся с оксидами не одного, а сразу двух металлов. Поскольку считалось, что Колумби тантал - это один элемент, то Ро е счел во можным дать название элеме ту, образующему втор ой окс д. Подчеркивая сходство, он назвал этот второй элемент, входящий в минерал, ниобием, по имени Ниобеи, до ери легендарного Т нтала. Впрочем, как Г. Розе, та и Ч. Хатчет не сумели получить н обий в сво бодном сос оян и. Металлическнй н об й был впервые получе л шь в 1866 г. шведским ученым Бломстрадом при восстановлении хлорида н обия водородом.
Приключения же с названием элеме та ниобия конч лись лишь в 1950 г. До этого в разных странах его называли по-разному. Если металл колумб и (как его назвали в Амер ке) попадал из США в Англию, то он продолжал называться колумбием. Если металл попадал в друг е страны, то становился ниоб ем. Конец этой раз оголос це положил Международный союз по теоретической и прикладной химии IUPAC Было решено узакон ть повсюду наз ание элемента «ниоб й», а за основным минералом состава Fе n)(Nb, Та) 2 О 6 закрепить название колумбит»
Глава III. Ниобий
Ниобий - это химический элементXX в.в прямом и переносном смысле. Хотя как элемент его открыли в самом начале XIX в. (1801 г.), но как металл был получен лишь век спустя (1907 г.), а сейчас без него не может обойтись техника двадцатого столетия. Получение коррозионноустойчивых и сверхжаропрочных сталей, конструирование аппаратуры для атомных реакторов, ракетная и космическая техника - вот далеко не полный перечень отраслей современной Промышленности, которые не могут обходиться без этого металла.
В свободном виде ниобий в природе не встречается, а в минералах почти всегда находится с танталом. Ниобиево-танталовых минералов сейчас насчитывается более семидесяти. Основные-это колумбит-танталит (Fe, Мn) (Та, Мn) 2 O 6 , в нем 85% - высших оксидов ниобия и тантала; лопарит (Na, Се, Са, Sr) (Nb, Ti) O 3 содержит 8-10% ниобия; (Nb, Та) 2 O 5 ; в пирохлор (Na, Ca) 2 (Nb, Ti) 2 O 6 (F, ОН) входит до 65% оксида ниобия (V).
III .1. Ниобий в свободном состоянии
Он настолько красив, что одно время пытались из него делать ювелирные изделия: своим светло-серым цветом ниобий напоминает платину. Несмотря на высокие температуры плавления (2500°С) и кипения (4840°C), из него легко можно сделать любое изделие. Металл настолько пластичен, что его можно обрабатывать на холоду. Очень важно, что ниобий сохраняет свои механические свойства при высоких температурах. Правда, как и в случае ванадия, даже небольшие примеси водорода, азота, углерода и кислорода сильно уменьшают пластичность и повышают твердость. Ниобий становится хрупким при температуре от - 100 до - 200 °С.
Получение ниобия в сверхчистом и компактном виде стало возможным с привлечением техники последних лет. Весь технологический процесс сложен и трудоемок. В принципе он делится на 4 этапа:
1) получение концентрата: феррониобия или ферротанталониобия;
2) вскрытие концентрата - перевод ниобия (и тантала) в какие-либо нерастворимые соединения, чтобы отделить от основной массы концентрата;
3) разделение ниобия и тантала и получение их индивидуальных соединений;
4) получение и рафинирование металлов.
Первые два этапа довольно просты и обычны, хотя и трудоемки. Степень разделения ниобия и тантала определяется третьим этапом. Стремление получить как можно больше ниобия и особенно тантала заставило изыскать новейшие методы разделения: избирательной экстракции, ионного обмена, ректификации соединений этих элементов с галогенами. В результате получают либо оксид, либо пятихлориды тантала и ниобия в отдельности. На последнем этапе применяют восстановление углем (сажей) в токе водорода при 1800°С, а затем температуру повышают до 1900°С и понижают давление. Получившийся при взаимодействии с углем карбид вступает в реакцию с Nb 2 O 5:
2Nb 2 O 5 + 5NbC = 9Nb + 5CO 3 ,
и появляется порошок ниобия. Если в результате отделения ниобия от тантала получен не оксид, а соль, то ее обрабатывают металлическим натрием при 1000°С и также получают порошкообразный ниобий. Поэтому при дальнейшем превращении порошка в компактный монолит проводят переплавку в дуговой печи, а для получения монокристаллов особо чистого ниобия используют электроннолучевую и зонную плавку.
III .2. Химические свойства ниобия
Ниобий особенно ценится за его устойчивость к действию неорганических и органических веществ.
Есть разница в химическом поведении порошкообразного и кускового металла. Последний более устойчив. Металлы на него не действуют, даже если нагреть их до высоких температур. Жидкие щелочные металлы и их сплавы, висмут, свинец, ртуть, олово могут находиться в контакте с ниобием долго, не меняя его свойств. С ним ничего не могут поделать даже такие сильные окислители, как хлорная кислота, «царская водка», не говоря уж об азотной, серной, соляной и всех прочих. Растворы щелочей на ниобий тоже не действуют.
Существует, однако, три реагента, которые могут переводить металлический ниобий в химические соединения. Одним из них является расплав гидроксида какого-либо щелочного металла:
4Nb+4NaOH+5О 2 = 4NaNbO 3 +2H 2 О
Двумя другими являются плавиковая кислота (HF) или ее смесь с азотной (HF+HNO). При этом образуются фторидные комплексы, состав которых в значительной степени зависит от условий проведения реакции. Элемент в любом случае входит в состав аниона типа 2- или 2- .
Если же взять порошкообразный ниобий, то он несколько более активен. Например, в расплавленном нитрате натрия он даже воспламеняется, превращаясь в оксид. Компактный ниобий начинает окисляться при нагревании выше 200°С, а порошок покрывается окисной пленкой уже при 150°С. При этом проявляется одно из чудесных свойств этого металла - он сохраняет пластичность.
В виде опилок при нагревании выше 900°С он полностью сгорает до Nb 2 O 5 . Энергично сгорает в токе хлора:
2Nb + 5Cl 2 = 2NbCl 5
При нагревании реагирует с серой. С большинством металлов он сплавляется с трудом. Исключение, пожалуй, составляют лишь два: железо, с которым образуются твердые растворы разного отношения, да алюминий, имеющий с ниобием соединение Al 2 Nb.
Какие же качества ниобия помогают ему сопротивляться действию сильнейших кислот-окислителей? Оказывается, это относится не к свойствам металла, а к особенностям его оксидов. При соприкосновении с окислителями на поверхности металла возникает тончайший (поэтому он и незаметен), но очень плотный слой оксидов. Этот слой встает неодолимой преградой на пути окислителя к чистой металлической поверхности. Проникнуть сквозь него могут только некоторые химические реагенты, в частности анион фтора. Следовательно, по существу металл окисляется, но практически результатов окисления незаметно из-за присутствия тонкой защитной пленки. Пассивность по отношению к разбавленной серной кислоте используют для создания выпрямителя переменного тока. Устроен он просто: платиновая и ниобиевая пластинки погружены в 0,05 м. раствор серной кислоты. Ниобий в пассивированном состоянии может проводить ток, если является отрицательным электродом - катодом, т. е. электроны могут проходить сквозь слой оксидов только со стороны металла. Из раствора путь электронам закрыт. Поэтому, когда через такой прибор пропускают переменный ток, то проходит только одна фаза, для которой платина - анод, а ниобий - катод.
III.3. Оксиды ниобия, кислоты и их соли
Число соединений с кислородом у ниобия невелико, значительно меньше, чем у ванадия. Объясняется это тем, что в соединениях, соответствующих степени окисления +4, +3 и +2, ниобий крайне неустойчив. Если атом этого элемента начал отдавать электроны, то он стремится отдавать все пять, чтобы обнажить стабильную электронную конфигурацию.
Если сравнивать ионы одной и той же степени окисления двух соседей по группе - ванадия и ниобия, то обнаруживается усиление свойств в сторону металлов. Кислотный характер оксида Nb 2 O 5 заметно слабее, чем у оксида ванадия (V). Кислоту при растворении он не образует. Лишь при сплавлении со щелочами или карбонатами проявляются его кислотные свойства:
Nb 2 O 5 + 3Nа 2 СО 3 = 2Nа 3 NbO 4 + ЗС0 2
Эта соль - ортониобат натрия - похожа на такие же соли ортофосфорной и ортованадиевой кислот. Однако у фосфора и мышьяка ортоформа самая устойчивая, а попытка получить ортониобат в чистом виде не удается. При обработке сплава водой выделяется не соль Nа 3 NbO 4 , а метаниобат NaNbO 3 . Это бесцветный труднорастворимый в холодной воде мелкокристаллический порошок. Следовательно, у ниобия в высшей степени окисления более устойчива не орто- , а мета-форма соединений.
Из других соединений оксида ниобия (V) с основными оксидами известны диниобаты K 4 Nb 2 O 7 , напоминающие о пирокислотах, и полиниобаты (как тень полифосфорных и поливанадиевых кислот) с примерными формулами K 7 Nb 5 O 16 . nH 2 O и K 8 Nb 6 O 19 . mH 2 O. Упомянутые соли, отвечающие высшему оксиду ниобия, содержат этот элемент в составе аниона. Форма этих солей позволяет считать их производными ниобиевых. кислот. В чистом виде эти кислоты получить нельзя, так как их скорее можно рассматривать как оксиды, имеющие связь с молекулами воды. Например, мета-форма - это Nb 2 O 5 . H 2 O, а орго-форма Nb 2 O 5 . 3H 2 O. Наряду с такого рода соединениями у ниобия есть и другие, где он уже входит в состав катиона. Ниобий не образует простых солей типа сульфатов, нитратов и т. д. При взаимодействии с гидросульфатом натрия NaHSО 4 или с оксидом азота N 2 О 4 появляются вещества со сложным катионом: Nb 2 О 2 (SО 4) 3 . Катионы в этих солях напоминают катион ванадия с той лишь разницей, что здесь ион пятизарядный, а у ванадия степень окисления в ионе ванадила равна четырем. Такой же катион NbO 3+ входит, в состав некоторых комплексных солей. Оксид Nb 2 O 5 довольно легко растворяется в водной фтористоводородной кислоте. Из таких растворов можно выделить комплексную соль K 2 . H 2 O.
На основании рассмотренных реакций можно сделать вывод, что ниобий в своей высшей степени окисления может входить как в состав анионов, так и в состав катиона. Это значит, что пятивалентный ниобий амфотерен, но все же со значительным преобладанием кислотных свойств.
Существует несколько способов получения Nb 2 O 5 . Во-первых, взаимодействие ниобия с кислородом при нагревании. Во-вторых, прокаливание на воздухе солей ниобия: сульфида, нитрида или карбида. В-третьих - наиболее обычный метод - обезвоживание гидратов. Из водных растворов солей концентрированными кислотами осаждается гидратированный оксид Nb 2 O 5 . xH 2 O. Затем при разбавлении растворов происходит выпадение белого осадка оксида. Обезвоживание осадка Nb 2 O 5 . xH 2 O сопровождается выделением теплоты. Вся масса накаляется. Происходит это из-за превращения аморфного оксида в кристаллическую форму. Оксид ниобия может быть двух цветов. В обычных условиях белый, но при нагревании приобретает желтую окраску. Стоит, однако, охладить оксид, как цвет исчезает. Оксид тугоплавок (t пл =1460°С) и нелетуч.
Более низким степеням окисления ниобия соответствуют NbО 2 и NbО. Первый из этих двух представляет собой черный с голубым отливом порошок. Получают NbO 2 из Nb 2 O 5 , отбирая кислород магнием или водородом при температуре около тысячи градусов:
Nb 2 O 5 + Н 2 = 2NbО 2 + Н 2 О
На воздухе это соединение легко переходит обратно в высший оксид Nb 2 O 5 . Характер его довольно скрытный, так как оксид нерастворим ни в воде, ни в кислотах. Все же ему приписывают кислотный характер на основании взаимодействия с горячей водной щелочью; при этом, однако, идет окисление до пятизарядного иона.
Казалось бы, разница в один электрон не так уж велика, но в отличие от Nb 2 O 5 , оксид NbO 2 проводит электрический ток. Очевидно, в этом соединении существует связь металл - металл. Если воспользоваться этим качеством, то при нагревании сильным переменным током можно заставить NbO 2 отдать свой кислород.
При потере кислорода NbO 2 переходит в оксид NbO, в дальнейшем довольно быстро отщепляется и весь кислород. О низшем оксиде ниобия NbО известно немного. Он имеет металлический блеск и по виду схож с металлом. Прекрасно проводит электрический ток. Словом, ведет себя так, будто кислорода в его составе вовсе и нет. Даже, подобно типичному металлу, бурно реагирует с хлором при нагревании и превращается в оксихлорид:
2NbO + 3Cl 2 =2NbOCl 3
Из соляной кислоты вытесняет водород (будто и не оксид он вовсе, а металл вроде цинка):
2NbO + 6HCl = 2NbOCl 3 + 3H 2
Получить в чистом виде NbО можно прокаливанием уже упоминавшейся комплексной соли K 2 с металлическим натрием:
К 2 + 3Na = NbO + 2KF + 3NaF
Оксид NbO имеет самую высокую из всех ниобиевых оксидов температуру плавления 1935° С. Чтобы очистить ниобий от кислорода, температуру повышают до 2300 - 2350° С, тогда одновременно с испарением происходит распад NbO на кислород и металл. Происходит рафинирование (очистка) металла.
III .4. Соединения ниобия
Рассказ об элементе был бы не полным без упоминания о его соединениях с галогенами, карбидами и нитридами. Это важно по двум причинам. Во-первых, благодаря фторидным комплексам удается отделить ниобий от его вечного спутника тантала. Во-вторых, эти соединения приоткрывают нам качества ниобия как металла.
Взаимодействие галогенов с металлическим ниобием:
2Nb + 5Cl 2 = 2NbCl 5 могут быть получены, все возможные пентагалогениды ниобия.
Пентафторид NbF 5 (t пл = 76 °С) в жидком состоянии и в парах бесцветен. Подобно пятифтористому ванадию, в жидком состоянии он полимерен. Атомы ниобия соединены друг с другом через атомы фтора. В твердом виде имеет структуру, состоящую из четырех молекул (рис. 2).

Рис. 2. Структура NbF 5 и TaF 5 в твердом виде состоит из четырех молекул.
Растворы в фтористоводбродной кислоте H 2 F 2 содержат различные комплексные ионы:
NbF 5 + H 2 F 2 = Н 2 ;
NbF 5 + H 2 O = H 2
Калиевая соль K 2 . H 2 O важна для отделения ниобия от тантала, так как в отличие от соли тантала она хорошо растворима.
Остальные пентагалогениды ниобия ярко окрашены: NbCl 5 желтый, NbBr 5 пурпурно-красный, NbI 2 коричневый. Все они возгоняются без разложения в атмосфере соответствующего галогена; в паре они мономеры. Температуры их плавления и кипения возрастают при переходе от хлора к брому и иоду. Некоторые из способов получения пентагалогенидов таковы:
2NbI 5 ;Nb 2 O 5 +5C+5Cl 2
2NbCl 5 +5CO;. 2NbF 5 +5Cl 2Пентагалогениды хорошо растворяются в органических растворителях: эфире, хлороформе, спирте. Водой, однако, полностью разлагаются -гидролизуются. В результате гидролиза получаются две кислоты -галогеноводородная и ниобиевая. Например,
NbCl 5 + 4H 2 О = 5HCl + H 3 NbО 4
Когда гидролиз нежелателен, то вводят какую-либо сильную кислоту и равновесие написанного выше процесса смещается в сторону NbCl 5 . В таком случае пентагалогенид растворяется, не подвергаясь гидролизу,
Особую признательность у металлургов заслужил карбид ниобия. В любой стали, есть углерод; ниобий, связывая его в карбид, повышает качества легированной стали. Обычно при сварке нержавеющей стали, шов имеет меньшую прочность. Введение ниобия в количестве 200 г на тонну помогает исправить этот недостаток. При нагревании ниобий раньше всех других металлов стали образует соединение с углеродом - карбид. Это соединение достаточно пластичное и в то же время способно выдерживать температуру до 3500° С. Слоя карбида толщиной всего в полмиллиметра достаточно, чтобы оградить от коррозии металлы и, что особенно ценно, графит. Карбид может получаться при нагревании металла или оксид ниобия (V) с углеродом или углеродсодержащими газами (СН 4 , СО).
Нитрид ниобия - соединение, на которое не действуют никакие кислоты и даже «царская водка» при кипячении; устойчив по отношению к воде. Единственное, с чем его можно заставить вступить во взаимодействие, - кипящая щелочь. В этом случае он разлагается с выделением аммиака.
Нитрид NbN светло-серый с желтоватым оттенком. Он тугоплавок (тем. пл. 2300°С), имеет замечательную особенность - при температуре, близкой к абсолютному нулю (15,6 К, или -267,4 °С), обладает сверхпроводимостью.
Из соединений, содержащих ниобий в более низкой степени окисления, более всего известны галогениды. Все низшие галогениды - твердые кристаллические вещества темного цвета (от темно-красного до черного). Устойчивость их уменьшается по мере понижения степени окисления металла.
Глава IV. Тантал
В честь древнего героя Тантала назван металл, значение которого в наши дни неизменно растет. С каждым годом расширяется круг его применений, а вместе с этим и потребность в нем. Однако руды его редки и содержание в них тантала невысокое.
Одним из сырьевых источников тантала являются шлаки оловянных концентратов. Промышленность поистине испытывает «танталовы муки» по поводу нехватки тантала.
IV.1. Тантал в свободном состоянии
Синеватый металл серого цвета, с исключительно прочной связью между атомами, что обусловливает большие значения его температур плавления (3000°С) и кипения (5300°С), Легко обрабатывается на холоду давлением. Механические свойства тантала лучше, чем у ниобия. Как при высоких, так и при низких температуpax он бывает пластичен и не становится хрупким даже при температуре жидкого азота (-196°С). Если содержит примеси азота, водорода, кислорода и углерода,тосвойства резко ухудшаются. Поэтому получение его в возможно чистом виде - основная задача при переработке танталового сырья. Даже если его значительно меньше, чем ниобия, и содержание составляет 0,01%, все равно это сырье представляет промышленную ценность. Кропотливой обработкой: обогащением, рудоразборкой, гравитационными методами с последующей флотацией, электромагнитной, электростатической или радиометрической сепарацией - создают танталовые концентраты. Они содержат до 60% (и даже больше) оксидов тантала и ниобия. Дальнейшая обработка происходит, как уже описано в разделе о ниобии. Конечными продуктами разделения обычно являются: оксид тантала Ta 2 O 5 , фторотанталат калия K 2 TaF 7 или пентахлорид TaCl 5 .
Существо проблемы получения металлического тантала связано с двумя его свойствами, которые, казалось бы, противоречат друг другу: он тугоплавок, но при небольшом нагревании легко вступает в реакцию окисления. Это преодолевают, применяя электрохимическое восстановление, а также восстановлением натрием или углем. Полученный в виде порошка или брикетов металлический тантал подвергают дальше спеканию с одновременным рафинированием в вакууме (рис. 39). В последние годы, так же как и для выплавки ниобия, все шире применяется дуговая или электронно-лучевая плавка, при этом происходит особенно сильная очистка металлов. Несмотря на трудность обработки и получения, сейчас за рубежом в год выпускают примерно 300 - 400 т чистого металла.
 Тантал более редкий и дорогой металл, чем ниобий: применение этого элемента отчасти сдерживается высокой его ценой. Потребность в тантале особенно велика в новейших отраслях производства. Атомная техника: самые ответственные части ядерных реакторов делаются из металлического тантала. Он может выдерживать большие температуры, не вступая во взаимодействие с теплоносителями и металлическим топливом. Металлургия: в состав сверхтвердых сплавов на ряду с карбидами вольфрама и титана входит карбид тантала ТаС (t пл
= 3800°С). Химическая промышленность: используется высокая коррозийная устойчивость тантала, не снижающаяся при нагревании.
Тантал более редкий и дорогой металл, чем ниобий: применение этого элемента отчасти сдерживается высокой его ценой. Потребность в тантале особенно велика в новейших отраслях производства. Атомная техника: самые ответственные части ядерных реакторов делаются из металлического тантала. Он может выдерживать большие температуры, не вступая во взаимодействие с теплоносителями и металлическим топливом. Металлургия: в состав сверхтвердых сплавов на ряду с карбидами вольфрама и титана входит карбид тантала ТаС (t пл
= 3800°С). Химическая промышленность: используется высокая коррозийная устойчивость тантала, не снижающаяся при нагревании.
Рис. 3. Методы получения металлов,
Непрерывная плавка (а):
А - расплав,
Б - вращающаяся затравка,
В-медные трубки охлаждения.
Восстановление водородом (б) :
1- кварцевая ила металлическая труба,
2 - держатели или кольцевые нагреватели,
3 - лодочка или емкость для образца,
4 - образцы,
5 - рычаг управления движением образцов.
Перечень хороших качеств металлического тантала (твердость, ковкость на холоду, пластичность, устойчивость к химическим воздействиям) следует дополнить особым свойством.. В отличие от других металлов тантал совершенно не раздражает соприкасающуюся с ним живую ткань. Тонкие пластиной и проволока из тантала - ценнейший материал костной и пластической хирургии. Танталовые заплаты на черепе, скрепление костей и даже сшивание нервов стали возможны благодаря такому удивительному свойству этого металла.
IV .2. Химические свойства тантала
Различие свойств тантала в виде кусков и порошкообразного так велико, что кажется, будто это два разных металла. Порошок при нагревании довольно энергично взаимодействует с кислородом (280°С):
4Та+5О 2 = 2Та 2 О 5 ,
с галогенами (250 - 300°С):
2Ta + 5Cl 2 = 2TaCl 5 ,
и даже с азотом (при накаливании до 600 о С в токе азота):
Металлический тантал же устойчив в подавляющем большинстве агрессивных сред. На него не действуют никакие кислоты и даже «царская водка». Исключение составляет лишь плавиковая кислота H 2 F 2 , но это из-за присутствия в ней иона фтора. Очень слабо действуют на него даже расплавы щелочей.
Секрет устойчивости металлического тантала состоит в том, что на его поверхности всегда имеется тонкая, но прочнейшая пленка оксида Ta 2 O 5 . Если вещество или соединение может вступать во взаимодействие с этой пленкой или проникать сквозь нее, то оно будет разрушать металл, а если нет, то тантал будет сохранять свою «неприступность». К реагентам, обладающим разрушительной способностью, относятся: ионы фтора, оксид серы (VI) да еще расплавы щелочей. Эта же пленка препятствует протеканию электрического тока от металла в раствор при электролизе (когда танталовый электрод служит анодом). Поэтому тантал используется в электронной технике для изготовления выпрямителей тока.
В отсутствие кислорода и азота тантал устойчив ко многим жидким металлам. Обескислороженный металлический натрий не действует на него даже при 1200°С, магний и сплавы - уран-магний и плутоний-магний - при 1150°С. Это позволяет использовать тантал для изготовления некоторых деталей ядерных реакторов.
Тантал способен поглощать довольно значительные количества (до 1%) водорода, кислорода и азота. Происходит процесс, который называется абсорбцией, - явление поглощения какого-либо вещества всем объемом поглотителя без образования прочных соединений. Подобный процесс обратим. Поглощенный водород при нагревании металла в вакууме при 600°С весь выделяется. Металл, которому водород придал хрупкость, восстанавливает свои прежние механические качества. Свойством тантала растворять газы пользуются, когда вводят его в качестве добавки в сталь.
При. повышенной температуре происходит образование соединений. При 500°С могут существовать гидриды Та 2 Н или ТаН в зависимости от содержания водорода в металле. Выше 600 - 700°С при взаимодействии с кислородом возникает оксид Та 2 О 5 , примерно при такой же температуре идет реакция с азотом - появляется нитрид тантала TaN. Углерод при высокой температуре (1200-1400°С) соединяется с танталом, давая ТаС - тугоплавкий и твердый карбид.
В расплавленных щелочах тантал окисляется с образованием солей танталовой кислоты, которые скорее можно считать смешанными оксидами 4Na 2 O . 3Та 2 О 5 . 25Н 2 О; 4К 2 О . 3Та 2 О 5 . 16Н 2 О. В плавиковой кислоте тантал растворяется с образованием фторидных комплексов типа [ТаF 6 ] - , 2- , 3- . Так как комплексы неустойчивы и гидролизуются, то в растворе находятся комплексы - продукты гидролиза [ТаОF 5 ] 2- , 3- .
IV .3. Химия танталовых соединений
Соединения тантала повторяют довольно близко свойства таких же образований ниобия. В основном известны соединения, где тантал имеет степень окисления +5. Однако при действии восстановителей могут возникать вещества с более низкими степенями окисления этого элемента. Наиболее хорошо изучены оксид Ta 2 O 5 и пятигалогениды TaF 5 и TaCl 5 , так как именно из них получают металл в свободном состоянии:
3Та 2 О 5 + 10А1 = 5А1 2 О 3 + 6Та;
2TaCl 5 = Ta + 5Cl 2 ;
K 2 TaF 7 +5Na = Ta + 5NaF + 2KF
Оксид тантала (V) -белый порошок, нерастворимый ни в воде, ни в кислотах (кроме H 2 F 2). Очень тугоплавкий (t пл = 1875°С). Кислотный характер оксида выражен довольно слабо и в основном проявляется при реакции с расплавами щелочей:
Та 2 О 5 + 2NаОН = 2NаТаО 3 + Н 2 О
или карбонатов:
Та 2 О 5 + 3Nа 2 СО 3 = 2Nа 3 ТаО 4 + 3СО 2
В основном оксид тантала (V) повторяет свойства аналогичного соединения ниобия. Поэтому я покажу их отличия друг от друга. Отличие первое- температура плавления оксида тантала (V) на 400°С выше, чем у оксида ниобия (V). Отличие второе - Ta 2 O 5 (плотность 8,71 г/см 3) почти в два раза тяжелее Nb 2 O 5 (4,55 г/см 3). Такое большое различие позволяет ориентировочно оценить состав смеси по ее плотности. Отличие третье - сплавление с карбонатом натрия в случае оксида тантала происходит труднее. Отличие четвертое - соли «танталовой кислоты» и щелочных металлов гидролизуются сильнее ниобатов. Уже при значении рН=6 (т. е. при концентрации ионов водорода 10~ 6 моль/л) происходит выделение студенистого осадка так называемой «танталовой кислоты». Однако она даже свежеприготовленная не растворяется ни в соляной, ни в азотной кислотах и в этом не похожа на ниобиевую. Пятое отличие - гель оксида тантала (V) легче, чем гель оксида ниобия (V), отщепляет воду. После удаления всей воды масса накаляется из-за мгновенной кристаллизации.
Соли, содержащие тантал в состоянии окисления -4, -5, могут быть нескольких видов: метатанталаты NaTaO 3 , ортотанталаты Nа 3 ТаО 4 , но существуют полиионы пента-и гекса-, кристаллизующиеся вместе с молекулами воды, 7- и 8- . Эти формы позволяют проводить аналогию не только с ниобием, но и с элементами главкой подгруппы-фосфором и мышьяком. С ниобием аналогия более полная, так как пятизарядный тантал образует при реакциях с кислотами катион ТаО 3+ и соли ТаО(NО 3) 3 или Nb 2 О 5 (SO 4) 3 , продолжая «традицию» побочной подгруппы, введенную ионом ванадия VO 2+ .
При 1000°С Ta 2 O 5 взаимодействует с хлором и хлороводородом:
Та 2 O 5 + 10НС1==2ТаС1 5 +5Н 2 О
Следовательно, можно утверждать, что и для оксида тантала (V) характерна амфотерность с превосходством кислотных свойств над свойствами основания.
В технике Та 2 O 5 получают из двойного фторидя 2KF . TaF 5 разложением его разбавленной серной кислотой:
2K 2 TaF 7 + 2H 2 SO 4 + 5H 2 O = Ta 2 O 5 + 2K 2 SO 4 + 14HF
Полученная таким способом студенеобразная масса загрязнена адсорбируемыми из раствора веществами. В чистом виде оксид получают прокаливанием металла в токе кислорода или окислением соединений, например карбидов:
4ТаС+9О 2 = 2Та 2 О 5 +4СО 2
Чистый Ta 2 O 5 не изменяется при прокаливании на воздухе, в атмосфере сероводорода и парах серы. Соединения почти все производятся от оксида тантала (V). Известны соединения и меньшей степени окисления, но они менее стабильны. При высокой температуре в смеси с углем оксид тантала (V) превращается вТаО 2:
2Та 2 O 5 + С = 4ТаО 2 + СO 2
Гидроксид, соответствующий оксиду тантала (V), получается нейтрализацией кислых растворов четырехлористого тантала. Эта реакция, также, подтверждает неустойчивость степени окисления +4.
При низких степенях окисления наиболее стабильные соединения -галогениды (см. рис. 3), Проще всего их получить через пиридиновые комплексы. Пентагалогениды TaX 5 (где Х- это С1, Вг, I) легко восстанавливаются пиридином (обозначается Ру) с образованием комплексов состава МХ 4 (Ру) 2 .
Затем небольшим нагреванием до 200° С можно разрушить пиридиновый комплекс;
TaI 4 (Py) 2 =TaI 4 +2Py
Тетрагалогениды представляют собой твердые кристаллические вещества с темной окраской от темно-оранжевой до черно-коричневой.
Взаимодействием тантала с серой при высоких температурах может быть подучен сульфид;
Ta + S 2 = TaS 2
Он не очень стоек и горячей водой разлагается с выделением сероводорода и водорода. В растворе выпадает студенистый осадок Та 2 О 5 . xН 2 О.
Чем ниже степень окисления, тем менее устойчивы соединения. Хлориды ТаС1 3 (черно-зеленый) и ТаСl 2 (оливковый) еще могут существовать при обычной температуре, а бромиды и иодиды нестойки и трудны для исследования.
Из других соединений интересны нитрид и карбид тантала.По существу их несколько. Известны низшие нитрид Ta 2 N и карбид Ta 2 C и высшие TaN и ТаС. Нитриды тугоплавки, серого цвета с голубоватым отливом; при температуре, близкой к абсолютному нулю, переходят в сверхпроводящее состояние. Нитриды более стойки, чем тантал, к действию кислорода. Получаются нагреванием тантала или Ta 2 O 5 до 1000 - 1500° С в атмосфере азота и водорода. Высокая температура плавления (около 3000°С) привлекает к ним внимание.Их используют как тугоплавкое покрытие для различных технических изделий.
Карбиды тантала исключительно высоко ценятся металлургами. Высший карбид ТаС имеет золотистый цвет и необычайно высокую температуру кипения 3800 °С (тем пл. 3500 °С). Это близко к температуре на поверхности Солнца. Введение карбидов в сплав повышает его прочность, жаростойкость и уменьшает хрупкость. Сами карбиды применяются в производствах, связанных с действием высоких температур, в качестве нагревателей, деталей печей, анодов и т. п.
IV.4. Применение тантала и ниобия
Рассматривая характер элемента и тех веществ, которые он образует, я уже обращала внимание на особенности, представляющие ценность для практического использования. Тантал, как и ниобий, применяется преимущественно в электровакуумной технике и химической промышленности. Однако все чаще и чаще мелькают в печати сообщения об использовании тантала наряду с ниобием в самолето- и ракетостроении, а вместе с тем, вероятно, и в космической технике.
Оба элемента обладают ценным сочетанием качеств. Способность поглощать газы хороша для поддерживания высокого вакуума: химическая инертность позволяет использовать их в высокоагрессивных средах, вплоть до атомных реакторов, и применять в медицине при костной и пластической хирургии. Металлы нисколько не вредят деятельности живых тканей организма. Настоящий переворот вызвало применение тантала, ниобия и их соединений в металлургии. Появилась возможность резко расширить ассоримент различных сталей и сплавов. Причем не только ниобий и тантал меняют характер сплавов, но и, наоборот, добавка к этим элементам других металлов придает им иные качества. Алюминий, например, повышает прочность металлического ниобия и тантала. Вольфрам и молибден увеличивают их теплостойкость. С добавлением меди увеличивается способность металлов проводить электрический ток. При этом сплав почти вдвое становится прочнее и тверже, чем медь.
Из тантала изготовляют фильеры для протяжки нитей в производстве искусственных волокон. Раньше такие фильеры делали из платины и золота. Самые твердые сплавы получают из карбида тантала с никелем в качестве цементирующей добавки. Они настолько тверды, что оставляют царапины даже на алмазе, который считается эталоном твердости.
За время, прошедшее после издания этой книги в 1973 г., накопилось немало новых данных о применении ниобия и тантала. Так, по сведениям, относящимся к январю 1975 г., первое место по величине критической температуры перехода в сверхпроводящее состояние было отдано германиду ниобия Nb 3 Ge. Его критическая температура составляет 23,2 К (примерно-250 °С). Другое соединение - станнид ниобия - становится сверхпроводником при немного более низкой температуре -255 °С. Чтобы полнее оценить этот факт, укажем, что большинство сверхпроводников известны лишь для температур жидкого гелия (2,172 К). Сверхпроводники из ниобиевых материалов позволяют изготавливать магнитные катушки, создающие чрезвычайно мощные магнитные поля. Магнит диаметром 16 см и высотой 11 см, где обмоткой служит лента из такого материала, способен создать поле колоссальной напряженностью. Необходимо только перевести магнит в сверхпроводящее состояние, т. е. охладить, а охлаждение до менее низкой температуры произвести, конечно, легче.
Важна роль ниобия в сварочном деле. Пока сваривали обычную сталь, никаких особых трудностей этот процесс не представлял и сложностей не создавал. Однако, когда начали сваривать конструкции из специальных сталей сложного химического состава, сварные швы стали терять многие ценные качества свариваемого металла. Ни изменения состава электродов, ни усовершенствование конструкций сварочных аппаратов, ни сварка в атмосфере инертных газов никакого эффекта не давали. Вот тут-то на помощь и пришел ниобий. Сталь, в которую как небольшая добавка введен ниобий, можно сваривать, не опасаясь за качество сварного (рис. 4) шва. Хрупкость шву придают возникающие при сварке карбиды, но способность ниобия соединяться с углеродом и препятствовать образованию карбидов других металлов, нарушающих свойства сплавов, спасли положение. Карбиды же самого ниобия, как и тантала, обладают достаточной вязкостью. Это особенно ценно при сварке котлов и газовых турбин, работающих под давлением и в агрессивной среде.,
Ниобий и тантал способны поглотить значительные количества таких газов, как водород, кислород и азот. При комнатной температуре 1 г ниобия способен поглотить 100 см 3 водорода. Но даже при сильном нагревании это свойство практически не слабеет. При 500°С ниобий еще может поглотить 75 см 3 водорода, а тантал в 10 раз больше. Этим свойством пользуются для создания высокого вакуума или в электронных приборах, где необходимо сохранить точные характеристики при высоких температурах. Ниобий и тантал, нанесенные на поверхность деталей, как губка, поглощают газы, обеспечивая стабильную работу приборов. С помощью этих металлов больших успехов достигла восстановительная хирургия. В медицинскую практику вошли не только пластинки из тантала, но и нити из тантала и ниобия. Хирурги успешно используют такие нити для сшивания порванных сухожилий, кровеносных сосудов и нервов. Танталовая «пряжа» служит для возмещения мускульной силы. С ее помощью хирурги укрепляют после операции стенки брюшной полости.Рис. 4. Конструкция хвостового оперенья самолета из жаропрочной ниобиевой стали.
Тантал имеет исключительно прочную связь между атомами. Это обусловливает его чрезвычайно высокую температуру плавления и кипения. Механические качества и химическая стойкость приближают тантал к платине. Химическая промышленность использует такое благоприятное сочетание качеств тантала. Из него готовят детали кислотостойкого оборудования химических заводов, нагревательные и охладительные устройства, имеющие контакт с агрессивной средой.
В бурно развивающейся атомной энергетике находят применение два свойства ниобия. Ниобий обладает удивительной «прозрачностью» для тепловых нейтронов, т. е. способен пропускать их через слой металла, практически с нейтронами не реагируя. Искусственная радиоактивность ниобия (получающаяся при контакте с радиоактивными материалами) невелика. Поэтому из него можно делать контейнеры для хранения радиоактивных отходов и установки по их переработке. Другим не менее ценным (для ядерного реактора) свойством ниобия является отсутствие заметного взаимодействия с ураном и другими металлами даже при температуре 1000 °С. и л m + 22 N актиноидов будут находиться в V, VI и т.д. груп
8. Г.Н. Фадеев. Пятая вертикаль – элементы V группы переодической системы
Д.И. Менделеева. М.: Просвещение. 1985.
9. Ю.М. Шилов, М.И. Тарасенко, Ю.И. Слушкович, П.М. Чукуров. Общая химия. М.: Медицина. 1983.
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter