Валентность, химическая связь и степень окисления - важнейшие понятия химии

Электроотрицательностью называется свойство химического элемента притягивать к своему атому электроны от атомов других элементов, с которыми данный элемент образует химическую связь в соединениях.
При образовании химической связи между атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, из-за чего связь становится ковалентно-полярной, а при большой разности электроотрицательностей – ионной.
Электроотрицательность учитывается при написании химических формул: в бинарных соединениях сзади записывается символ наиболее электроотрицательного элемента.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Валентностью элемента называется свойство его атомов соединяться с определенным числом других атомов.
Различают стехиометрическую, электронную валентность и координационное число. Мы рассмотрим только стехиометрическую валентность.
Стехиометрическая валентность показывает, сколько атомов другого элемента присоединяет атом данного элемента. За единицу валентности принята валентность водорода, т.к. водород всегда одновалентен. Например, в соединениях HCl, H 2 O, NH 3 (правильное написание аммиака Н 3 N уже используется в современных пособиях), СН 4 хлор одновалентен, кислород двухвалентен, азот трехвалентен и углерод четырехвалентен.
Стехиометрическая валентность кислорода обычно равна 2. Так как почти все элементы образуют соединения с кислородом, то удобно его использовать в качестве эталона для определения валентности другого элемента. Например, в соединениях Na 2 O, CoO, Fe 2 O 3 , SO 3 натрий одновалентен, кобальт двухвалентен, железо трехвалентно, сера шестивалентна.
В окислительно-восстановительных реакциях нам важно будет определять степени окисления элементов.
Степенью окисления элемента в веществе называется его стехиометрическая валентность, взятая со знаком плюс или минус.
Химические элементы подразделяются на элементы постоянной валентности элементы переменной валентности.
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
В зависимости от того, в каком состоянии соединения находятся в природе, они делятся на молекулярные и немолекулярные. В молекулярных веществах мельчайшими структурными частицами являются молекулы. Эти вещества имеют молекулярную кристаллическую решетку. В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая.
Тип кристаллической решетки во многом определяет свойства веществ. Например, металлы, имеющие металлический тип кристаллической решетки , отличаются от всех остальных элементов высокой пластичностью, электро- и теплопроводностью . Эти свойства, а также и многие другие – ковкость, металлический блеск и т.п. обусловлены особым видом связи между атомами металла -- металлической связью. Необходимо отметить, что свойства, присущие металлам, проявляются только в конденсированном состоянии. Например, серебро в газообразном состоянии не обладает физическими свойствами металлов.
Особый тип связи в металлах – металлическая – обусловлен дефицитом валентных электронов, поэтому они общие для всей структуры металла. Наиболее простая модель строения металлов предполагала, что кристаллическая решетка металлов состоит из положительных ионов, окруженных свободными электронами, движение электронов происходит хаотически, подобно молекулам газа. Однако такая модель, качественно объясняя многие свойства металлов, при количественной проверке оказывается недостаточной. Дальнейшая разработка теории металлического состояния привела к созданию зонной теории металлов , которая основывается на представлениях квантовой механики.
В узлах кристаллической решетки находятся катионы и атомы металла, а электроны свободно перемещаются по кристаллической решетке .
Характерным механическим свойством металлов является пластичность , обусловленная особенностями внутреннего строения их кристаллов. Под пластичностью понимают способность тел под действием внешних сил подвергаться деформации, которая остается и после прекращения внешнего воздействия. Это свойство металлов позволяет придавать им различную форму при ковке, прокатывать металл в листы или вытягивать в проволоку.
Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующих кристаллическую решетку, сдвигаются относительно друг друга без разрыва. Это происходит в результате того, что переместившиеся электроны благодаря свободному перераспределению продолжают осуществлять связь межу ионными слоями. При механическом воздействии на твердое вещество с атомной решеткой смещаются отдельные ее слои и сцепление между ними нарушается из-за разрыва ковалентных связей.
ионы , то эти вещества образуют ионный тип кристаллической решетки .

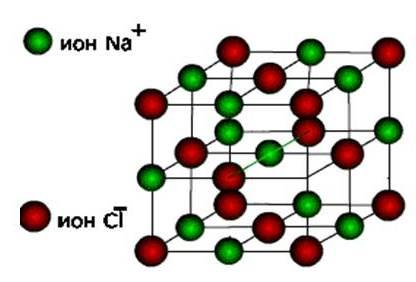
Это соли, а также оксиды и гидроксиды типичных металлов. Это твердые, хрупкие вещества, но основное их качество: растворы и расплавы этих соединений проводят электрический ток .
Если в узлах кристаллической решетки находятся атомы , то эти вещества образуют атомный тип кристаллической решетки (алмаз, бор, кремний оксиды алюминия и кремния). По свойствам очень твердые и тугоплавкие, нерастворимы в воде.
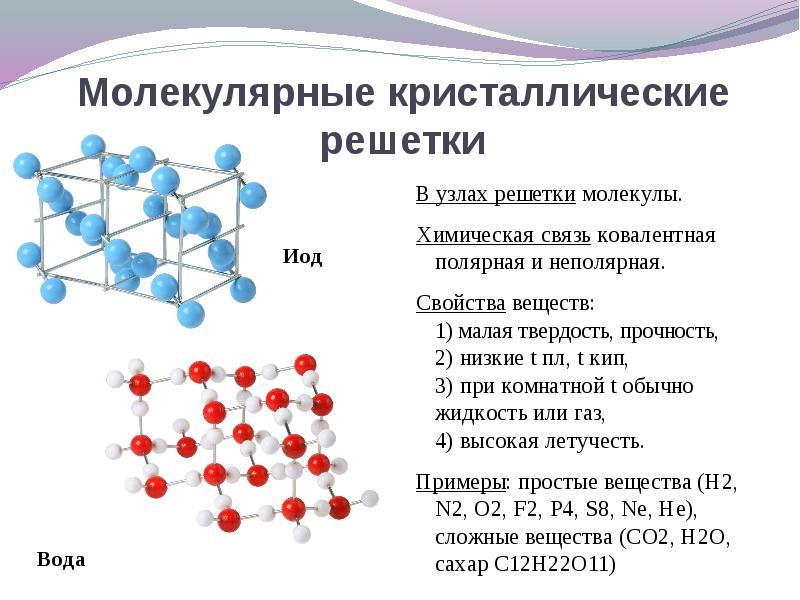
Если в узлах кристаллической решетки находятся молекулы , то эти вещества образуют (при обычных условиях газы и жидкости: О 2 , HCl; I 2 органические вещества).
Интересно отметить металл галлий, который плавится при температуре 30 о С. Эта его аномалия объясняется тем, что в узлах кристаллической решетки находятся молекулы Ga 2 и его свойства в чем становятся схожи с веществами, имеющие молекулярную кристаллическую решетку.
Пример. Немолекулярное строение имеют все неметаллы группы:
1) углерод, бор, кремний; 2) фтор, бром, иод;
3) кислород, сера, азот; 4) хлор, фосфор, селен.
В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая
При решении этого вопроса проще идти от противного. Если в узлах кристаллической решетки находятся молекулы , то эти вещества образуют молекулярный тип кристаллической решетки (при обычных условиях газы и жидкости: О 2 , HCl; также I 2, ромбическая сера S 8 , белый фосфор Р 4 , органические вещества). По свойствам это непрочные легкоплавкие соединения.
Во втором ответе есть газ фтор, в третьем – газы кислород, азот, в четвертом – газ хлор. Значит, эти вещества имеют молекулярную кристаллическую решетку и молекулярное строение.
В первом ответе все вещества – твердые соединения при обычных условиях и образуют атомную решетку, значит, имеют немолекулярное строение.
Правильный ответ: 1) углерод, бор, кремний
VALENCE, CHEMICAL ВАЛЕНТНОСТЬ, ХИМИЧЕСКАЯ BOND, AND EXTENT OF OXIDATION – KEY СВЯЗЬ И СТЕПЕНЬ ОКИСЛЕНИЯ – NOTIONS IN CHEMISTRY ВАЖНЕЙШИЕ ПОНЯТИЯ ХИМИИ Ya. A. UGAI ь. Д. мЙДв The terms “valence” and ЗУ УМВКТНЛИ „УТЫ‰‡ ТЪ‚ВММ˚И ЫМЛ‚В ТЛЪВЪ “chemical bond” are inti- mately connected with ЗЗЦСЦзаЦ each other and happen to Впервые понятие валентности было введено в be fundamental ones in химию английским химиком Эдвардом Франклен- modern chemistry. At the дом в 1853 году. Под валентностью он понимал чис- same time such notion, as ло атомов другого элемента, соединяющихся с од- ним атомом данного элемента или замещающих его the “extent of oxidation” в соединениях. Общепринята была одновалентность playing a certain role in атома водорода. Тогда валентность другого элемента the interpretation of redox выражалась числом атомов водорода, которое может присоединить или заместить один атом рассматрива- processes and the classi- емого элемента. Кроме того, существовала валент- fication of chemical com- ность по кислороду, исходившая из его двухвалентно- pounds has a remote сти. У большинства элементов численные значения валентности по водороду и кислороду различны. association with the Э. Франкленд (вместе с немецким химиком valence and is not directly Адольфом Кольбе) обнаружил трехвалентность related to the chemical азота, фосфора, мышьяка и четырехвалентность уг- лерода. Оказалось, что валентность зависит от со- bond. стояния атомов рассматриваемого элемента, хими- ческой природы партнера, с которым реагирует иУМflЪЛfl ‚‡ОВМЪМУТЪЛ Л данный элемент, и условий взаимодействия. Так, углерод с одним и тем же партнером – кислородом ıЛПЛ˜ВТНУИ Т‚flБЛ МВ- в зависимости от условий взаимодействия образует ‡Б ˚‚МУ Т‚flБ‡М˚ ПВК- CO2 и CO, в которых состояния атомов углерода ‰Ы ТУ·УИ Л fl‚Оfl˛ЪТfl УТ- различны. На основе валентности элементов легко определить формульный состав химического со- МУ‚УФУО‡„‡˛˘ЛПЛ ‰Оfl единения. Поэтому валентность часто называли ТУ‚ ВПВММУИ ıЛПЛЛ. З стехиометрической валентностью. Понятие стехио- ЪУ КВ ‚ ВПfl ФУМflЪЛВ метрической валентности сыграло исключительно важную роль в открытии Периодического закона и ТЪВФВМЛ УНЛТОВМЛfl, Т˚„- создании теории химического строения, хотя и ‡‚¯ВВ УФ В‰ВОВММЫ˛ Дмитрий Иванович Менделеев и Александр Ми- УО¸ Ф Л ЛМЪВ Ф ВЪ‡ˆЛЛ хайлович Бутлеров вслед за Фридрихом Кекуле в основном пользовались термином “атомность” УНЛТОЛЪВО¸МУ-‚УТТЪ‡МУ- вместо “валентности”. ‚ЛЪВО¸М˚ı Ф УˆВТТУ‚ Л С развитием химии комплексных соединений НО‡ТТЛЩЛН‡ˆЛЛ ıЛПЛ˜В- появилось понятие координационного числа или координационной валентности. Под ними подразу- ТНЛı ТУВ‰ЛМВМЛИ, ‚ ‰ВИ- мевается число атомов, молекул, ионов, которые ТЪ‚ЛЪВО¸МУТЪЛ ЛПВВЪ УЪ- образуют первую координационную сферу комп- © м„‡И ь.Д., 1997 ‰‡ОВММЫ˛ Т‚flБ¸ Т ‚‡- лексообразователя. Кроме того, еще Альфред Вер- нер различал в комплексных соединениях главную ОВМЪМУТЪ¸˛ Л МВ ЛПВВЪ и побочную валентности. Например, в комплекс- Ф flПУ„У УЪМУ¯ВМЛfl Н ном соединении Cl3 атом хрома с тремя ıЛПЛ˜ВТНУИ Т‚flБЛ. атомами хлора связан главной валентностью, а с шестью нейтральными молекулами аммиака – ко- ординационной валентностью. мЙДв ь.Д. ЗДгЦзнзйлнъ, паеауЦлдДь лЗьбъ а лнЦиЦзъ йдалгЦзаь 53 Следует особо подчеркнуть, что во всех случаях пень окисления равна −1; 3) степень окисления ще- валентность выступает как формальная числовая лочных металлов равна +1; 4) степень окисления характеристика элемента, хотя и тесно связанная с атомов, входящих в состав простых веществ, равна химической связью. Ибо химическая связь – взаи- нулю; 5) в любом ионе алгебраическая сумма всех модействие атомов одного и того же или разных степеней окисления равна заряду иона, а в нейт- химических элементов, в процессе которого проис- ральных молекулах эта сумма равна нулю. ходит перестройка электронных оболочек связыва- Важность окислительного числа заключается ющихся атомов с одновременным образованием прежде всего в том, что номер группы Периодичес- единого электронного облака, сопровождающееся кой системы указывает на высшую положительную понижением энергии всей системы (молекула, кри- степень окисления (характеристическая степень сталл, радикал, комплекс и т.д.). Поэтому часто упо- окисления), которую могут иметь элементы данной требляют выражение “валентная связь” . По- группы в своих соединениях. Исключения состав- следнее выражение указывает на необходимость ляют металлы подгруппы меди, кислород, фтор, ме- рассматривать понятие валентности и химической таллы семейства железа и некоторые другие эле- связи в тесном взаимодействии. Впервые представ- менты VIII группы. Кроме того, понятие степени ления о химической связи были введены Бутлеровым окисления полезно при классификации химичес- в его теории химического строения. По Бутлерову, ких соединений, а также при составлении уравне- само химическое строение молекул и, следователь- ний окислительно-восстановительных реакций. но, их свойства в первую очередь зависят от атомов, связанных силами главного химического сродства, й айззйв лЗьба а также и не связанных между собой непосредствен- но, но оказывающих влияние друг на друга. Конеч- Первоначально Вальтер Коссель (1916 год) счи- но, в то время (1861 год) не могло быть и речи об тал, что при химическом взаимодействии разнород- электронной теории химической связи, поскольку ные атомы стремятся приобрести конфигурацию первые квантовомеханические концепции химиче- внешней электронной оболочки благородных га- ской связи появились в 20-х годах ХХ века. зов. Это достигается отдачей и присоединением Однако не следует думать, что квантовомехани- электронов нейтральными атомами химических ческая интерпретация решает проблему химичес- элементов. Атомы, отдающие свои электроны, пре- кой связи однозначно. Даже такое важное понятие, вращаются в положительно заряженные ионы (ка- как энергия связи, особенно для многоатомных мо- тионы) и проявляют положительную валентность. лекул, носит полуколичественный характер, кото- Атомы, принимающие электроны, превращаются в рый удобен для общей ориентировки и качественных отрицательно заряженные анионы. Химическая сравнений. Вообще же обрисовать взаимозависи- связь осуществляется за счет электростатического мость и взаимообусловленность теоретических по- притяжения образовавшихся разноименных ионов. нятий, затронутых в этой статье, на современном В этом заключается сущность теории ионной связи. научном уровне, – весьма нелегкая задача. Поэтому Однако идеально ионных соединений вообще не целью статьи является разграничение понятий ва- существует. Даже при химическом взаимодействии лентности, химической связи и степени окисления, наиболее электроположительных и электроотрица- а отнюдь не глубокое рассмотрение указанных тер- тельных элементов образуются сильно полярные минов на уровне современной науки. соединения с наибольшей долей ионности. К ион- Среди формальных понятий химии важнейшим ным соединениям близки только галогениды щелоч- является понятие степени окисления (синонимы: ных металлов, хотя и для них эффективные заряды “окислительное число”, “состояние окисления”, не достигают единицы. Все остальные соединения, в “степень окисленности”, “электрохимическая ва- том числе галогениды, оксиды, сульфиды и т.д., яв- лентность”, “электровалентность”). Степень окис- ляются полярными соединениями. Кроме того, эф- ления – воображаемый заряд атома элемента в со- фективные заряды типичных электроотрицатель- единении, который определяется из предположения ных атомов (кислород, сера) почти не превосходят ионного строения вещества . Определение степе- единицы, в то время как заряды атомов элементов- ней окисления элементов основано на следующих металлов могут быть заметно больше единицы. Это предположениях: 1) степень окисления кислорода объясняется тем, что энергия присоединения двух принимается равной − 2. Исключение составляют электронов к кислороду и сере (сродство к электрону пероксидные соединения (Na2O2), где степень второго порядка) отрицательна, то есть необходи- окисления кислорода −1, а также надпероксиды мо затратить эту энергию на образование О2 − и S2 −. (KO2) и озониды (KO3), окислительное число кис- Расчеты показывают, что сродство к электрону вто- лорода в которых равно соответственно −1/2 и −1/3. рого порядка равно для кислорода 732, а для серы – Наконец, во фторидах кислорода степень окисле- 334 кДж/моль. ния кислорода положительна, например в OF2 она Значит, ионы типа O2 −, S2 − не существуют и все ок- равна +2; 2) водород имеет степень окисления +1. сиды и сульфиды независимо от активности метал- Только в солеобразных гидридах типа NaH его сте- лов относятся к полярным соединениям. Согласно 54 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹3, 1997 данным опытов по рассеянию молекулярных пуч- При этом одна обобществленная электронная пара ков, ионы типа O2 − и S2 − могут существовать лишь соответствует одной “единице валентности”. Общая как чрезвычайно неустойчивые частицы со време- электронная пара, ответственная за химическую нем жизни порядка 10−10 с. Если двухзарядные ио- связь, иначе называется поделенной парой электро- ны в действительности не существуют, тем более нов. Возникновение кратной (двойной и тройной) нереальны многозарядные одноатомные отрица- связи сопровождается образованием соответствен- тельные ионы. но двух или трех поделенных электронных пар. Самопроизвольная передача электрона от атома Таким образом, ковалентная связь осуществля- металла к атому неметалла в действительности вряд ется электронной парой, находящейся в общем вла- ли осуществляется. Дело в том, что потенциал ио- дении двух атомов, образующих химическую связь. низации первого порядка даже для наиболее актив- Ковалентную связь между одинаковыми атомами ных щелочных металлов больше, чем сродство к (например, в H2 , N2) называют также атомной, электрону типичных электроотрицательных эле- или гомеополярной (атомную, или гомеополярную, ментов. С этой точки зрения оказывается энергети- связь иногда называют также неионной). Молекулы чески невыгодным образование ионной молекулы или соединения, образованные на основе этих свя- NaCl из элементов, так как первый ионизационный зей, называются неполярными или гомеополярны- потенциал натрия равен 5,14 эВ, а сродство к элек- ми. Их электрический дипольный момент равен ну- трону атома хлора − 3,7 эВ (ионизационный потен- лю. Ковалентная связь возникает и при химическом циал численно равен энергии ионизации в элек- взаимодействии атомов разных химических эле- трон-вольтах). Из квантовой механики следует, что ментов. Тогда обобществленная электронная пара полное разделение зарядов с возникновением иде- (или электронные пары) несколько смещается в альной ионной связи А1+В1− никогда не может осу- сторону более электроотрицательного партнера. ществиться, так как из-за волновых свойств элек- Несмотря на такое смещение, электронная пара трона вероятность его нахождения вблизи ядра продолжает быть коллективной собственностью атома А может быть мала, но отлична от нуля. Таким обоих взаимодействующих атомов. Такая ковалент- образом, вопреки довольно распространенному мне- ная связь называется полярной и показана на при- нию чисто ионных соединений с идеальной ионной мере образования молекулы HF: связью на самом деле не существует. Такие соедине- H⋅ + ⋅F: Hd+ :F:d −, : : : : ния лучше называть преимущественно ионными. Между тем принято считать, что химическая где d < 1. Таким образом, полярная связь не является связь у подавляющего большинства неорганичес- самостоятельным типом химической связи, а пред- ких соединений носит ионный характер. Объясня- ставляет собой результат поляризации ковалентной ется это двумя исторически сложившимися причи- связи (поляризация – явление смещения электриче- нами. Во-первых, почти все химические реакции ских зарядов под действием внешних сил). исследовались в водной среде и представляли по су- В широком смысле ковалентная связь – химичес- ществу ионные реакции. При растворении в воде кая связь между атомами, осуществляемая обобще- веществ даже с малополярной связью образуются ствленными электронами. Ковалентная связь явля- гидратированные ионы благодаря высокой поляр- ется универсальным типом химической связи. ности молекул и большой диэлектрической посто- Межатомная связь абсолютного большинства янной воды. Во-вторых, в неорганической химии неорганических и органических соединений кова- исключительно важную роль играет электронная лентна. По механизму образования ковалентных теория окислительно-восстановительных реакций, связей нет никакой разницы между неорганичес- постулирующая переход электронов от восстанови- ким соединением аммиаком NH3 и органическим телей к окислителям. При этом заведомо неионные соединением метаном CH4 . Для неорганических соединения рассматриваются как вещества с ион- соединений типа кислот, оснований и солей наблю- ной связью, а степень окисления элемента полно- даются межатомные связи с несколько большей до- стью отождествляется с его валентностью. лей ионности, то есть более полярные ковалентные Таким образом, нужно говорить о большей или связи по сравнению с органическими соединения- меньшей степени ионности (доле ионности). Иде- ми. Следовательно, по фундаментальной характе- альная же ионная связь наравне с идеальными газа- ристике молекул – природе межатомной химичес- ми и идеальными растворами скорее представляет кой связи – нет принципиальной разницы между собой типичный пример научной абстракции . неорганической и органической химией. дйЗДгЦзнзДь лЗьбъ ийзьнаЦ й дЗДзнйЗйв паеаа Главное в учении о ковалентной связи – обоб- Квантовая химия – современное учение о хими- ществление валентных электронов. В молекуле во- ческом и кристаллохимическом строении вещества, дорода обобществляются электроны от каждого а также о взаимосвязи между строением и свойства- атома водорода, которые и являются валентными. ми на основе представлений и методов квантовой мЙДв ь.Д. ЗДгЦзнзйлнъ, паеауЦлдДь лЗьбъ а лнЦиЦзъ йдалгЦзаь – ЗДЬзЦвтаЦ ийзьнаь паеаа 55 механики (более детальное изложение см. в статье открытие и разработку химии гиперкоординиро- Н.М. Витковской “Методы молекулярных орбита- ванного углерода. лей: основные идеи и важные следствия” в “Соро- Расчеты В. Гейтлера и Ф. Лондона показали, что совском Образовательном Журнале” (1996. № 6. пребывание двух электронов с антипараллельными С. 58–64)). спинами в поле двух ядер энергетически более вы- Уже первые расчеты молекулы водорода, прове- годно, чем нахождение одного электрона в поле сво- денные в 1927 году Вальтером Гейтлером и Фрицем его ядра. Тогда объяснение ковалентности состоит в Лондоном, показали: 1) ковалентную (парноэлек- том, что каждый атом для образования химической тронную двухцентровую) связь образуют два элек- связи предоставляет один неспаренный электрон. трона с антипараллельными спинами; 2) при возник- Поскольку у атома водорода всего лишь один элек- новении ковалентной связи происходит увеличение трон в нормальном и возбужденном состояниях, он электронной плотности между взаимодействующи- функционирует как одновалентный элемент. ми атомами (приблизительно на 15–20 %), что при- У атома гелия в нормальном состоянии нет не- водит к уменьшению энергии системы и ее стаби- спаренных электронов – оба его электрона нахо- лизации; 3) ковалентная связь направлена в сторону дятся на орбитали 1s. Возбуждение же атома с пере- максимального перекрывания электронных обла- ходом электрона из состояния с одним значением ков взаимодействующих атомов (критерий наи- главного квантового числа (особенно для низких большего перекрывания). значений) на орбиталь с другим значением кванто- вого числа требует большой затраты энергии. Для В методе молекулярных орбиталей благодаря атома гелия энергия перехода электрона 1s 2s трудам Джона Леннарда-Джонса, Фридриха Гунда и равна 1672 кДж/моль. Такие высокие энергии воз- особенно Роберта Малликена состояние электронов буждения в условиях обычных химических реакций в многоатомной системе описывается молекуляр- не наблюдаются, поэтому гелий не образует хими- ными орбиталями (МО), подобно тому как электро- ческих соединений. Таким образом, согласно так ны в атомах характеризуются атомными орбиталями называемой спиновой теории, валентность элемен- (АО). При этом и АО и МО представляют собой од- та определяется числом неспаренных электронов ноэлектронные волновые функции. Разница лишь как в нормальном, так и возбужденном состоянии. в том, что АО – одноцентровые, а МО – многоцент- Способ образования ковалентной связи, когда каж- ровые орбитали. Метод молекулярных орбиталей дый из взаимодействующих атомов отдает по одно- дает возможность автоматически учитывать поля- му электрону для образования общей электронной ризацию химической связи, а полярность в рамках пары, называется обменным. Однако нередко ва- этого метода не нуждается в понятии валентности. лентность элемента превосходит число неспарен- Вместо нее вводится понятие “порядок связи”, ха- ных электронов у его атомов в основном состоянии. рактеризующее в некоторых условных единицах Происходит это потому, что помимо обменного ме- кратность образующейся химической связи, а пото- ханизма образования ковалентной связи существу- му отображающее по существу превращенную фор- ет и другой, заключающийся в том, что один атом му валентности. Порядок связи может принимать отдает в общее пользование неподеленную пару как целочисленные, так и дробные значения, но электронов, а партнер предоставляет свободную ор- при этом он всегда при наличии химической связи биталь. Первый называется донором, а второй – ак- должен быть положительным. Метод молекуляр- цептором. Ковалентную связь, образующуюся за ных орбиталей позволяет с единых позиций описы- счет неподеленной пары электронов донора и сво- вать как основное, так и возбужденные состояния бодной орбитали акцептора, называют донорно-ак- молекул. Кроме того, с позиций этого метода мож- цепторной связью. Схематически ее образование но интерпретировать связи как с дефицитом, так и с может быть показано так: избытком электронов по сравнению с обычными двухцентровыми двухэлектронными связями (кова- Д: + А = Д: A. лентная связь). Донорно-акцепторный механизм возникнове- В последнее время усиленно развивается кон- ния ковалентной связи отличается от обменного цепция химических связей с избытком валентных только происхождением общей электронной пары, электронов. Так, для трактовки химических соеди- ответственной за химическую связь. Во всем ос- нений благородных газов, интергалогенидов высо- тальном эти связи тождественны: понижение об- ких степеней окисления и их комплексов, а также щей энергии системы, антипараллельность спинов карборанов и их производных успешно применяет- электронов, перекрывание электронных облаков. ся теория гипервалентных связей. Они называются также электроноизбыточными или орбитально-де- лнЦиЦзъ йдалгЦзаь фицитными связями . Достаточно указать, что в 1994 году Нобелевская премия в области химии бы- Несмотря на широкое применение в химии по- ла присуждена профессору Калифорнийского уни- нятия “степень окисления”, оно является сугубо верситета Джорджу Ола (Лос-Анджелес, США) за формальным. В настоящее время экспериментально 56 лйкйлйЗлдав йЕкДбйЗДнЦгъзхв ЬмкзДг, ‹3, 1997 определяемые истинные заряды атомов в соедине- Cl− Cl− Cl− ниях не имеют ничего общего со степенями окисле- − ния этих элементов. Так, действительные заряды Cl W 3+ W 3+ Cl− атомов водорода и хлора в молекуле HCl соответст- − Cl Cl− Cl− венно равны +0,17 и − 0,17 (а степени окисления +1 и −1). В кристаллах сульфида цинка ZnS заряды ато- Cl− мов цинка и серы равны +0,86 и − 0,86 вместо фор- Анион 3− мальных степеней окисления +2 и − 2. Как видно из структуры этого кластера, каждый Нельзя отождествлять степень окисления с ва- атом вольфрама со степенью окисления W3+ харак- лентностью элемента, если даже их абсолютные теризуется девятью ковалентными связями, из ко- значения совпадают. Валентность атома, определя- торых три образованы по обменному механизму, а емая как число химических связей, которыми дан- шесть валентных связей с шестью атомами хлора – ный атом соединен с другими атомами, не может по донорно-акцепторному. иметь знака (+ или −) и равняться нулю. Поэтому особенно неудачны выражения “положительная и ганЦкДнмкД отрицательная валентность” и тем более “нулевая валентность”, бытующие поныне в химической ли- 1. Некрасов Б.В. Основы общей химии. М.: Химия, тературе. Рассмотрим пример метана CH4 , метило- 1973. Т. 1. вого спирта CH3OH, формальдегида HCOH, муравь- 2. Угай Я.А. Общая и неорганическая химия. М.: иной кислоты HCOOH и диоксида углерода CO2 , в Высш. шк., 1996. которых валентность углерода равна четырем, а сте- 3. Угай Я.А. Общая химия. М.: Высш. шк., 1984. пени окисления его – соответственно − 4, − 2, 0, +2, 4. Корольков Д.В. Электронное строение и свойства со- +4. К тому же для установления валентности атома единений непереходных элементов. СПб.: Химия, требуется знание химического строения, а опреде- 1992. ление степени окисления производится в отрыве от 5. Угай Я.А. Неорганическая химия. М.: Высш. шк., структуры вещества, то есть формально. 1989. Прекрасной иллюстрацией глубокого разли- чия между валентностью и степенью окисления * * * элемента являются хорошо изученные комплекс- Яков Александрович Угай, профессор Воронеж- ные соединения некоторых переходных металлов, ского государственного университета, доктор хи- именуемые кластерами , в которых между ком- мических наук, академик Международной акаде- плексообразователями возникают ковалентные мии наук высшей школы, лауреат Государственной связи по обменному механизму. Так, трихлорид премии СССР, заслуженный деятель науки России. вольфрама с хлоридом калия образует комплекс Число научных публикаций превышает 500. Автор и 2WCl3 ⋅ 3KCl≡K3, анион которого имеет хи- соавтор 10 книг (учебников, учебных пособий и мо- мическое строение нографий). Имеет 41 авторское свидетельство. мЙДв ь.Д. ЗДгЦзнзйлнъ, паеауЦлдДь лЗьбъ а лнЦиЦзъ йдалгЦзаь – ЗДЬзЦвтаЦ ийзьнаь паеаа 57
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter