Глава III. Строение вещества
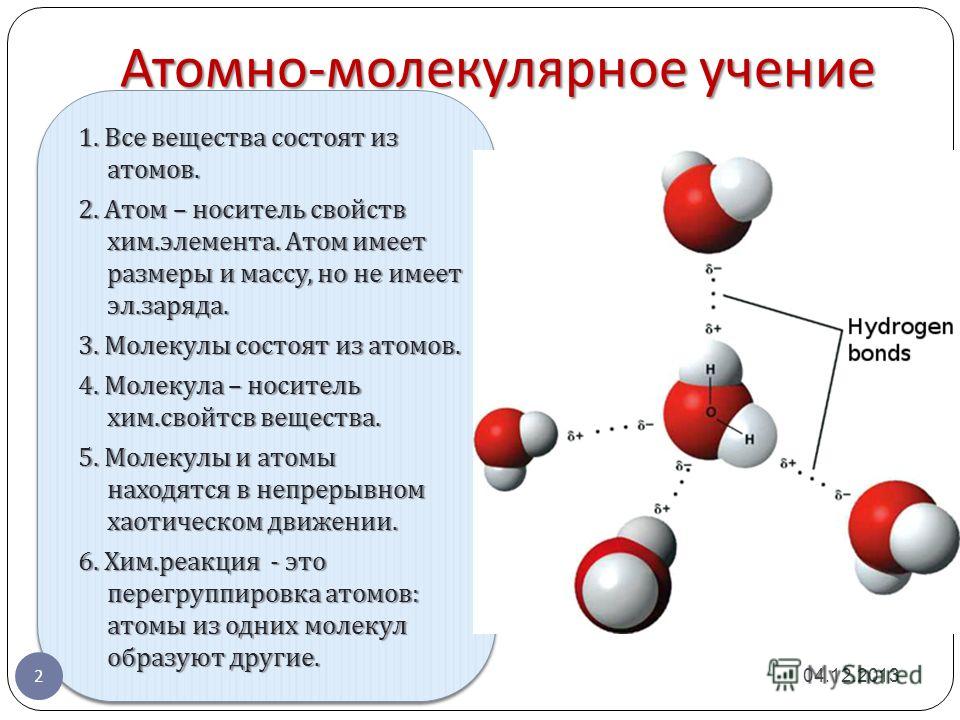
1. Все вещества состоят из атомов. 2. Атом – носитель свойств хим. элемента. Атом имеет размеры и массу, но не имеет эл. заряда. 3. Молекулы состоят из атомов. 4. Молекула – носитель хим. свойтсв вещества. 5. Молекулы и атомы находятся в непрерывном хаотическом движении. 6. Хим. реакция - это перегруппировка атомов: атомы из одних молекул образуют другие. 1. Все вещества состоят из атомов. 2. Атом – носитель свойств хим. элемента. Атом имеет размеры и массу, но не имеет эл. заряда. 3. Молекулы состоят из атомов. 4. Молекула – носитель хим. свойтсв вещества. 5. Молекулы и атомы находятся в непрерывном хаотическом движении. 6. Хим. реакция - это перегруппировка атомов: атомы из одних молекул образуют другие. Атомно - молекулярное учение


Основные положения АМУ Вещества состоят из атомов и молекул Молекулы в химических реакциях разрушаются Атомы в химических реакциях сохраняются Атомы разных химических элементов отличаются друг от друга размером, массой и другими свойствами Молекулы и атомы находятся в непрерывном движении Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества

Атом

Определение атома Атомы - это химические частицы, являющиеся пределом химического разложения любого вещества. Атомы не делимы химическим путём. Размеры атомов Масса атомов разных видов составляет порядка г, размеры атомов колеблются в пределах 1· · м, поэтому атомы считаются мельчайшими химическими частицами.

Строение атомов Атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательные электроны. Строение атома можно представить в виде, так называемой, планетарной модели, которую предложил Эрнест Резерфорд. Она представляет собой мини - солнечную систему, где в центре находится ядро (Солнце), вокруг которого вращаются электроны (планеты солнечной системы).


Молекула

Примеры атомов и молекул

Аллотропия

Аллотропия

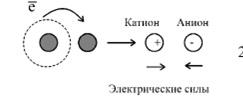
Заряженная частица, состоит из атома или группы атомов, химически связанных друг с другом. Ион Заряд обусловлен избытком (знак «-») или недостатком (знак «+») электронов. Катион Анион Положительно заряженый ионОтрицательно заряженый ион Cl-, SO4-, OH-H+, Ca2+, Al3+

Химический элемент Химическое обозначение элемента состоит из одной или двух латинских букв.

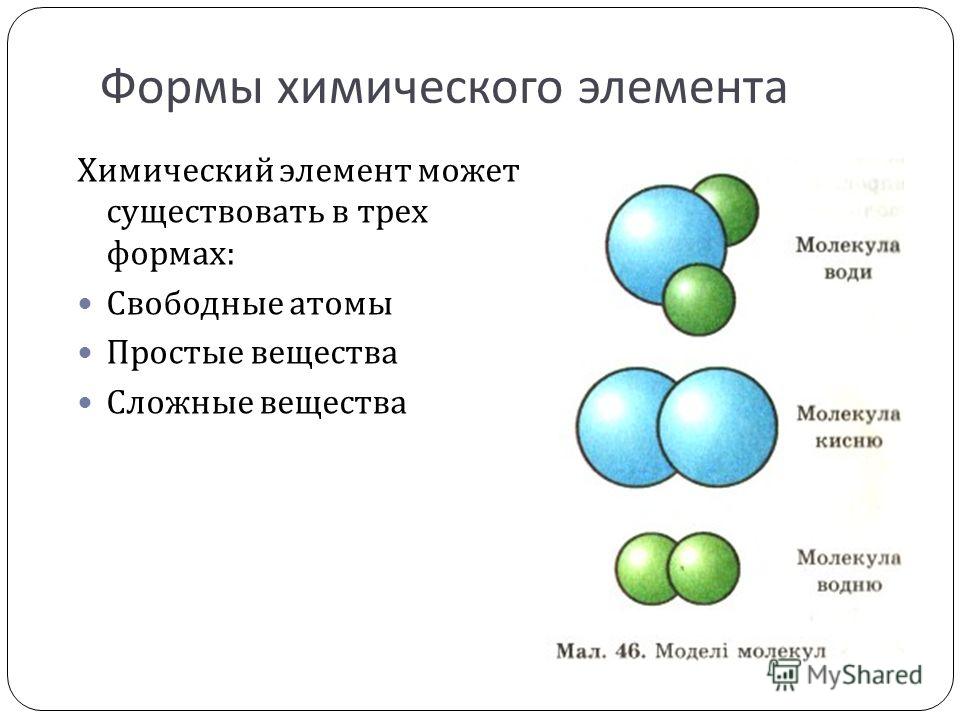
Атомы большинства химических элементов не могут долго существовать поодиночке. Они соединяются с такими же или другими атомами. Например, огромное количество атомов металлического элемента, соединяясь вместе, образует металл. Алмаз, графит, красный фосфор состоят из соединенных между собой атомов неметаллических элементов. Два атома кислорода объединяются в молекулу О 2 ; из таких молекул состоит газ кислород. Вода содержит молекулы Н 2 О, каждая из которых образована двумя атомами водорода и одним атомом кислорода. Поваренная соль (хлорид натрия) состоит не из молекул, а из ионов Na + и Cl – .
Образование химической связи всегда сопровождается выделением энергии, называемой энергией химической связи . Таким образом, причиной образования химической связи является уменьшение энергии, повышение устойчивости системы.
Среди простых веществ лишь инертные газы – гелий, неон, аргон, криптон, ксенон и радон (элементы VIIA группы) – состоят из отдельных атомов. Долгое время ученым не удавалось осуществить химические реакции с участием инертных газов. Причина химической пассивности этих веществ стала понятна только после открытия строения атома.
У неона, аргона, криптона, ксенона и радона на последнем энергетическом уровне по 8 электронов (среди них – два s -электрона и шесть p -электронов), исключением является гелий у которого два электрона заполняют первый энергетический уровень до завершения.
Учитывая химическую пассивность инертных газов и строение атомов соответствующих элементов, можно сделать вывод, что внешняя восьмиэлектронная оболочка является для атома выгодной и устойчивой. Ее часто называют электронным октетом.
Атомы остальных химических элементов стремятся приобрести электронный октет, образуя химические связи с атомами этого же или другого химического элемента, отдавая и принимая электроны либо обобществляя электроны.
1. Причиной образования химической связи является стремление атомов к достижению более устойчивого состояния, что приводит к выделению энергии при образовании химической связи.
2. Природа химической связи – электростатическая, т.е. определяется различными видами взаимодействий электронов и ядер в системе связанных атомов.
Особенности строения атомов, образующих ионную химическую связь. Ионная химическая связь образуется между атомами типичных металлических элементов и типичных неметаллических элементов.
Особенностями атомов металлов является небольшое (1-3) количество электронов на последнем энергетическом уровне, у атомов же неметаллических элементов электронов на последнем энергетическом уровне от 4 до 8. Кроме того радиус атома металла больше радиуса атома неметалла, если они находятся водном периоде и имеют одинаковое количество энергетических уровней. Электроотрицательность металлов значительно меньше электроотрицательности неметаллов (∆ ОЭО > 2).
Рис. Радиусы атомов элементов III периода.
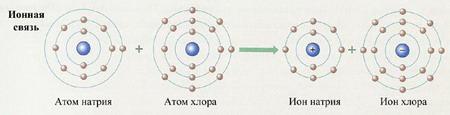
Образование ионной химической связи. Примером образования ионной связи является хлорид натрия (поваренная соль). Составляющие ее элементы – натрий и хлор находятся в III периоде периодической системы. Их относительная электроотрицательность (ОЭО) соответственно равна у Na – 1,1, а у Cl – 2,8. Натрий (№11) находится в периодической системе после инертного элемента неона. Электронная конфигурация атома натрия –
1s 2 2s 2 2p 6 3s 1 . На последнем энергетическом уровне в атоме имеется лишь один электрон, а на предпоследнем – октет электронов (2s 2 2p 6 ). Электронная конфигурация атома хлора (№17) – 1s 2 2s 2 2p 6 3s 2 3p 5 , на последнем энергетическом уровне хлора семь электронов, среди них один неспаренный p -электрон. За счет неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы в электроотрицательности связь между атомами натрия и хлора будет образовываться за счет отдачи и присоединения электрона:
Ядра атомов при этом не изменяются (а значит, и сами элементы тоже). В ядре атома натрия содержится 11 электронов (заряд ядра равен +11), а электронов становится на один меньше, т. е. 10 (их суммарный заряд равен –10). Электронейтральный атом превращается в частицу, которая имеет заряд +11 – 10 = +1. Это – ион натрия Na + . Его электронное строение такое же, как и атома инертного элемента неона; ион натрия является устойчивой частицей с внешним октетом электронов (8 электронами на последнем энергетическом уровне).
Схема превращения атома натрия в ион натрия и электронные конфигурации этих частиц:
Na 0 – 1e - → Na + ;
атом Na 0 – 1s 2 2s 2 2p 6 3s 1 , или 3s 1 ;
ион Na + – 1s 2 2s 2 2p 6 , или
Катионы Na + входят в состав почти всех соединений натрия, среди которых – оксид Na 2 O, гидроксид NaOH, различные соли.
В ядре атома хлора содержится 17 электронов (заряд ядра равен +17), а электронов становится на один больше, т. е. 18 (их суммарный заряд равен –18). Электронейтральный атом превращается в частицу, которая имеет заряд +17 – 18 = –1. Это – ион хлора Cl – . Его электронное строение такое же, как и атома инертного элемента аргона; ион хлора тоже является устойчивой частицей с внешним октетом электронов (8 электронами на последнем энергетическом уровне).
Схема превращения атома хлора в ион хлора и электронные конфигурации этих частиц:
Cl 0 + 1e - → Cl – ;
атом Cl 0 – 1s 2 2s 2 2p 6 3s 2 3p 5 , или 3s 2 3p 5 ;
ион Cl – – 1s 2 2s 2 2p 6 3s 2 3p 6 , или
Анионы Cl – содержатся в солях соляной (хлороводородной) кислоты – хлориде натрия NaCl, хлориде кальция – CaCl 2 и др.
Многие вещества состоят из ионов. Положительно заряженные ионы в результате действия электростатических сил соединяются с отрицательно заряженными.Как положительные, так и отрицательные ионы могут состоять не только из одного, но из нескольких элементов. Например, кристаллы калийной селитры (нитрата калия) KNO 3 образованы положительными ионами (катионами) калия К + и отрицательными нитрат – ионами (анионами) . Связь между ионами К + и ионная, а между атомами N и О в ионе – ковалентная.
К ионным соединениям относятся оксиды металлов, щелочи, соли. Все эти вещества содержат ионы металлических элементов (например, Na + , Ca 2+ , Al 3+). Анионами в ионных оксидах являются ионы О 2 – , в щелочах – ОН – , а в солях – ионы кислотных остатков (Cl – , , , и др.).
Кроме тог из ионов состоят некоторые другие бинарные соединения, образованные бинарными соединениями, образованные типичными металлическими элементами, например Li 3 N, Mg 3 P 2, NaH.
Отличия ионов от атомов. Катион и атом натрия имеют одинаковые заряды ядер (+11), анион и атом хлора – тоже (+17). Однако состав электронных оболочек, размеры (радиусы), свойства простого иона и атома каждого элемента различны. Кроме того, ионы – заряженные ионы, а атомы – электронейтральные.
1s 2 2s 2 2p 6 3s 1 или 3s 1 1s 2 2s 2 2p 6 3s 2 3p 5 или 3s 2 3p 5
R (Na) > R (Cl)
0,171 нм 0,072 нм
1s 2 2s 2 2p 6 или 1s 2 2s 2 2p 6 3s 2 3p 6 или [Аr]
R(Na +) < R (Na) R (Na +) < R (Cl -) R (Cl -) ≈ R (Cl)
0,028 нм 0,171 нм 0,028 нм 0,074 нм 0,074 нм 0,072 нм
Сопоставив радиусы атомов и ионов, катионов и анионов, можно обнаружить такие закономерности:
Радиусы катионов меньше, чем радиусы соответствующих атомов;
Радиусы анионов и соответствующих атомов почти одинаковы;
Радиусы большинства анионов превышают радиусы катионов.
Сравним некоторые свойства катиона и атома водорода. Ионы Н + содержатся в водном растворе кислоты и придают ему кислый вкус. Атомы водорода такими свойствами не обладают. В отличии от ионов, они легко соединяются друг с другом в молекулы Н 2 , из которых состоит простое вещество – водород.
Ионы в природе. При обычных условиях большинство ионных соединений находится в твердом агрегатном состоянии. При определенных условиях (высокие температуры, растворение в воде) ионные соединения распадаются на ионы. Ионы в природе существуют вокруг нас. Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья. Ионы активны, результатом их взаимодействия часто бывают негативные явления: насыщение почвы нитрат-ионом (), разрушение мраморных изделий сульфат-ионом (), кислотные дожди (ионы Н + , , ), загрязнение воды и почвы токсичными ионами тяжелых металлов.
1. Записать формулу вещества.
4. Валентные электроны каждого атома обозначают вокруг символа элемента. Составить схему образования связи для этого показать взаимодействие атомов (переход электронов от атома металла к атому неметалла для ионной связи).
1. Наиболее устойчивая внешняя электронная оболочка атома или простого иона содержит восемь электронов.
2. Атомы металлических элементов способны отдавать электроны внешней оболочки и превращаться в катионы, а атомы неметаллических элементов – присоединять электроны и превращаться анионы.
3. Катионы и анионы притягиваются друг к другу за счет электростатических сил, между ними образуется ионная химическая связь.
4. Катионы имеют меньшие радиусы, чем соответствующие атомы. Радиусы анионов почти не отличаются от радиусов соответствующих атомов.
Все ионные соединения в обычных условиях являются, как правило, кристаллическими веществами. Кристалл – это естественное твердое тело, которое имеет плоские грани
(поверхности) и прямые ребра (стыки поверхностей). Такая форма твердого тела является
результатом четкой последовательности в размещении частиц.
Кристаллы каждого вещества имеют характерную форму. Если посмотреть на поваренную соль через увеличительное стекло, то увидим множество бесцветных прозрачных кубиков.
Форму кристалла изучает наука кристаллография. Химию интересует внутреннее строение кристаллов и зависимость свойств веществ от их кристаллической структуры.
В кристалле ионного вещества каждый катион находится в контакте с определенным количеством анионов, а анион – с таким же или другим количеством катионов. В любом направлении наблюдается строгое чередование катионов и анионов.
Последовательность размещения ионов внутри кристалла зависит от состава вещества, т. е. соотношения катионов и анионов, а также от соотношения радиусов этих частиц.
Внутреннее строение кристаллов описывают с помощью модели, название которой кристаллическая решетка. Это схема или объемный макет размещения частиц в небольшой части кристалла. Исходя из такой модели, можно воспроизвести строение вещества в целом.Шарики в кристаллической решетке имитируют частицы вещества – ионы, атомы, молекулы. Они размещены в так называемых узлах кристаллической решетки.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами. Связь между ионами осуществляется за счет электростатических сил притяжения (ионная химическая связь).
Физические свойства ионных соединений. Ионы соединяются друг с другом достаточно прочно. Поэтому все ионные вещества при обычных условиях находятся в твердом агрегатном состоянии.
Для того, чтобы разрушить ионную связь, необходимо затратить немалую энергию. Этим объясняют высокие температуры плавления и кипения большинства ионных веществ. При плавлении кристаллы разрушаются, связи между ионами ослабевают, а при кипении ионы отделяются друг от друга и «вылетают» из жидкости. Хлорид натрия плавится при температуре 801 0 С (ее нельзя достичь, нагревая вещество с помощью спиртовки), а кипит при температуре 1440 0 С. Температуры кипения и плавления другого ионного соединения – оксида магния MgO – еще выше: 2825 и 3600 0 С. Объяснить это можно так. Ионы Mg 2+ и О 2 – имеют большие заряды и меньшие радиусы, чем ионы Na + и Cl – соответственно, и поэтому прочнее соединяются.
Ионные вещества в твердом состоянии не проводят электрический ток, а в растворе и расплаве являются электропроводными.
В кристалле ионы занимают фиксированное положение и перемещаться не могут.
В растворе и расплаве химические связи разрушаются, и ионы становятся свободными. При погружении в расплав заряженных электродов, соединенных с постоянным источником тока ионы начинают передвигаться упорядоченно. Катионы начинают двигаться к отрицательно заряженному электроду, анионы – к положительно заряженному. Так в растворе и расплаве вещества с ионной кристаллической решеткой возникает электрический ток.Вещества с иной кристаллической решеткой не пластичны. Это можно объяснить тем, что при деформации кристаллической решетки слои смещаются друг относительно друга и ионная химическая связь разрушается (в какой-то момент катион оказывается напротив катиона, а анион напротив аниона и возникают силы отталкивания).
Большинство веществ с ионной кристаллической решеткой хорошо растворяется в воде.
1. Твердые вещества бывают кристаллическими и аморфными. В кристаллах частицы строго упорядочены и образуют кристаллическую решетку, в аморфных веществах они расположены хаотично.
2. Физические свойства веществ зависят от строения вещества (особенности строения атомы определяют тип химической связи, тип химической связи определяет тип кристаллической решетки, от типа кристаллической решетки зависят физические свойства).
Соединяться могут не только противоположно заряженные ионы, но и нейтральные атомы – одинаковые или разные. Благодаря этому существуют вещества молекулярного и атомного строения.
Особенности строения атомов, образующих ковалентную химическую связь. Ковалентная химическая связь образуется между атомами неметаллических элементов.
У атомов элементов-неметаллов на последнем энергетическом уровне от 4 до 8 электронов. Радиус атома металла больше, чем радиус атома неметалла, если элементы находятся в одном периоде и их атомы имеют одинаковое количество энергетических уровней. Поэтому валентные электроны неметаллов гораздо сильнее притягиваются к ядру, чем валентные электроны атомов металлов. Электроотрицательность атомов неметалла одного итого же элемента одинакова, а электроотрицательность атомов различных неметаллов отличается незначительно (∆ ОЭО < 2).
Образование ковалентной химической связи. Рассмотрим, как образуется молекула Н 2 из двух атомов водорода. Каждый атом имеет один электрон. Электронная конфигурация
атома водорода – 1s 1 , его электронно-графическая схема
Для того, чтобы образовалась молекула Н 2 , двум атомам водорода необходимо сблизиться. Однако два атома водорода при их сближении и взаимодействии друг с другом могут образовать двухатомную молекулу не всегда. Химическая связь между двумя атомами водорода (или атомами других элементов) возможна в этом случае, если их электроны имеют противоположные спины (в противном случае преобладают силы отталкивания).
С уменьшением расстояние между атомами водорода усиливается притяжение электронов каждого атома к ядру другого атома. В определенный момент орбитали двух атомов соприкасаются, а затем начинают перекрываться. При этом будет возрастать отталкивание между одноименно (положительно) заряженными ядрами атомов. Когда силы притяжения и отталкивания уравниваются, атомы остановятся. В результате энергия системы, состоящей из двух атомов водорода, уменьшается (Е выделяется), между атомами образуется химическая связь. Область повышенной двухэлектронной плотности связывает два атома водорода в молекулу Н 2 .
Условно уплотненную часть двухэлектронного облака называют общей электронной парой и обозначают ее .
Итак, химическая связь между атомами водорода осуществляется общей парой электронов. Каждый из атомов отдает на образование связи по одному своему s -электрону. Каждый атом водорода «приобретает» дополнительный электрон и выгодную электронную оболочку (как у атома гелия).Схема образования ковалентной химической связи в молекуле водорода выглядит следующим образом:
Схематично перекрывание электронных облаков изображают так:
Подобным образом осуществляется ковалентная химическая связь между атомами хлора, но она устанавливается уже между p -электронами атомов этого элемента:
Рассмотрим, как соединяются два разных атома неметаллических элементов – водорода и хлора.
Связь возникает за счет образования общей электронной пары s- и p -электронов.
В молекулах водорода, хлора и хлороводорода атомы связаны одной общей электронной парой. Такую связь называют одинарной.
Химическая связь между атомами в молекулах может быть образована с помощью большего числа общих электронных пар. Это зависит от строения взаимодействующих атомов. С помощью общих электронных пар объединяются атомы и в двухатомной молекуле
азота – N 2 . Связь между атомами здесь тройная :Из вышеизложенного следует, что необходимым условием для образования ковалентной связи между атомами является наличие у каждого из них одного или нескольких неспаренных электронов.
Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает энргию связи, а значит, прочность молекул:
Способы перекрывания перекрывания электронных орбиталей. В молекуле водорода Н 2 область перекрывания s- орбиталей атомов водорода расположена на прямой, соединяющей ядра атомов (а ). Такую связь называют σ-связью . Она существует и в молекуле Cl 2 , где перекрывается p -орбитали двух атомов хлора (б ). Такая же связь образуется в молекуле НCl, в этой молекуле перекрываются s– орбиталь атома водорода и p -орбиталь атома хлора (в )Рассмотрим, как перекрываются орбитали с непареными электронами в молекуле кислорода.
О 2 – кислород:
В молекуле кислорода связь двойная . Одна общая электронная пара образуется за счет
σ–связи (электронная плотность находится на линии, проходящей через ядра связанных атомов.).
Другая связь образуется за счет перекрывания вертикально направленных p -орбиталей. Такое перекрывание происходит уже не по линии, проходящей через ядра связанных атомов, а по обе стороны от нее. Образуется не одна, а две области перекрывания. Такая ковалентная связь получила название π-связи
Если одинарная связь всегда является σ–связью (молекула водорода), то двойная связь состоит из одной σ–связи и одной π-связи (молекула кислорода), тройная же связь состоит из из одной σ–связи и двух π-связей (молекула азота)
.
Область перекрывания орбиталей в случае σ–связи больше, чем в случае π-связи, поэтому энергии при образовании σ–связи выделяется больше, чем при образовании π-связи.
Поэтому σ–связь прочнее и выгоднее, чем π-связь.
1. Ковалентными связями соединяются друг с другом атомы неметаллических элементов.
2. Ковалентная связь образуется с помощью одной, двух, или трех общих электронных пар за счет неспаренных электронов.
3. Связь между атомами с помощью одной общей пары называется одинарной (простой), двух пар – двойной, трех пар – тройной.
4. Одинарная ковалентная связь всегда является σ–связью, двойная состоит из одной σ–связи и одной π-связи, тройная же связь состоит из одной σ–связи и двух π-связей.
Ковалентная связь устанавливается между атомами не только одного элемента-неметалла, но и разных элементов-неметаллов с близкими значениями электроотрицательности (∆ ОЭО < 2). Примером таких соединений могут служить молекулы фтороводорода и хлороводорода, воды, аммиака, оксида углерода (IV).
Вспомним, как образуется химическая связь в молекуле хлороводорода:
В данном случае перекрываются сферическая s- орбиталь атома водорода и гантелеобразная p -орбиталь атома хлора. Эта химическая связь также ковалентная. Она осуществляется общей электронной парой, в образовании которой каждый из этих атомов поставляет по одному электрону. Так как электроотрицательность хлора несколько больше электроотрицательности водорода, общая электронная пара оказывается смещенной к атому хлора. Этот атом приобретает небольшой отрицательный заряд, который меньше единицы (он равен –0,2), а атом водорода – такой же заряд по значению, но положительный (+0,2). Дробные заряды на атомах обозначаются греческой буквой δ («дельта») вместе со знаком «плюс» или «минус». Такую химическую связь называют полярной. Полярность ковалентной связи в схемах изображают так:
Сравнивая значения электроотрицательности двух связанных атомов, можно оценить полярность ковалентной связи между ними. Чем больше разность электроотрицательностей (∆ОЭО), тем сильнее общая электронная пара смещена к более электроотрицательному атому и тем полярнее ковалентная связь. Например, в ряду галогеноводородов HF – HCl – HBr – HI полярность связи закономерно уменьшается: самая полярная связь в молекуле HF (∆ОЭО = 3,98 – 2,20 = 1,78), а наименее полярная – в молекуле HI (∆ОЭО = 2,66 – 2,20 = 0,46). Во всех этих молекулах общая электронная пара смещена к атому галогена.
Помимо полярности ковалентная химическая связь характеризуется и некоторыми другими свойствами. Длиной связи называют расстояние между ядрами связанных атомов. Атомы сближаются на такое расстояние, при котором достигается наибольшее перекрывание их электронных орбиталей, а энергия молекулы становится минимальной. Длина связи сравнима с размерами атомов и обычно составляет 0,1 – 0,2 нм. Самая маленькая длина связи в молекуле водорода Н 2 – 0,076 нм, так как атом водорода имеет наименьший
радиус.Молекулу Н 2 невозможно разглядеть даже в электронный микроскоп. Известны и гораздо более крупные молекулы. Примером может служить молекула ДНК, ответственная за передачу наследственной информации в растительных и животных клетках. В клетке молекла ДНК содержится в свернутом виде, образуя хромосомы. Если бы удалось ее раскрутить, получилась бы тончайшая нить длиной в человеческий рост при диаметре всего 2 нм.
Ковалентная связь образуется между двумя атомами, т. е. характеризуется направленностью. Если один атом образует несколько связей, то они направлены под определенным углом друг к другу. Угол между связями (валентный угол) – это угол между линиями, соединяющими химически связанные атомы. Валентные углы в молекулах бывают разные: от 90 до 180 0 С. Зная все валентные углы и длины всех связей, можно определить геометрическую форму молекулы.
Алгоритм составления схемы образования химической связи:
1. Записать формулу вещества.
2. Определить по номеру периода номер последнего энергетического уровня, по номеру группы количество валентных электронов. По количеству валентных электронов определить характер свойств элемента. Определить тип связи (по разнице в ОЭО)
Составить электронно-графическую схему последнего энергетического уровня каждого элемента, по схеме определить количество электронных пар и неспаренных электронов. Валентные электроны каждого атома обозначают вокруг символа элемента. Составить схему образования связи для этого показать взаимодействие атомов (переход электрон для ионной связи, образование общих электронных пар для ковалентной связи) Для ковалентной связи составить структурную формулу. Для ковалентной связи показать перекрывание электронных орбиталей. Указать σ– и π-связи.
1. При соединении атомов химических элементов-неметаллов с одинаковой электроотрицательностью смещения общей электронной пары не происходит и образуется ковалентная неполярная связь.
2. Если ковалентная связь образуется между атомами различных элементов-неметаллов с различной электроотрицательностью (∆ ОЭО < 2), то атомы приобретают небольшие заряды. Их появление вызвано смещением общей электронной пары к атому с большей электроотрицательностью. Такую ковалентную связь называется полярной.
Молекулярные кристаллические решетки – это решетки, в узлах которых расположены молекулы, стянутые между собой слабыми силами межмолекулярного взаимодействия. Примерами веществ с молекулярной кристаллической решеткой могут служить кристаллический иод и «сухой лед» (углекислый газ в твердом агрегатном состоянии). Эти вещества состоят из молекул.
Твердое и жидкое состояние молекулярных веществ существует
благодаря тому, что молекулы притягиваются друг к другу. Это явление называется межмолекулярным взаимодействием.
В отличие от прочных ковалентной и ионной связей взаимодействие между молекулами довольно слабое.
Физические свойства молекулярных соединений. Вследствие того что молекулы слабо притягиваются друг к другу, вещества молекулярного строения существенно отличаются
от молекулярного строения существенно отличаются от веществ ионного строения по физическим свойствам.Молекулярные вещества при обычных условиях могут находиться в газообразном, жидком или твердом агрегатном состоянии. Агрегатное состояние зависит от относительной молекулярной массы вещества. Чем больше относительная молекулярная масса, тем больше межмолекулярное взаимодействии и меньше расстояние между молекулами, а значит, выше плотность. Молекулярные вещества с низкой молекулярной массой при обычных условиях газообразны.
Жидкие и твердые молекулярные вещества летучи. Немало молекулярных веществ имеет
запах. Всем хорошо известен резкий запах оксида серы(IV), или сернистого газа SO 2 ; вещество образуется при зажигании спички (сера входит в состав ее головки). Газ аммиак NH 3 также легко узнать по запаху. Он выделяется из водного раствора этого соединения – нашатырного спирта. Нельзя перепутать с другими запах уксусной кислоты СН 3 СООН, раствор которой (уксус) используют в кулинарии.
У веществ с молекулярной кристаллической решеткой отсутствует пластичность. При деформации кристаллической решетки, слои смещаются относительно друг друга, при этом слабые межмолекулярные связи разрушаются.
Вещества с молекулярной решеткой имеют небольшую механическую прочность и сравнительно низкие температуры кипения и плавления. Наличие этих свойств обусловлено тем, что силы притяжения между молекулами в кристаллах этих веществ и недостаточно прочные и сравнительно легко разрываются при внешних воздействиях.
Некоторые молекулярные вещества при нагревании переходят из твердого агрегатного состояния в газообразное, минуя жидкое. Такое явление называется сублимацией . Этим свойством обладают, например, иод, углекислый газ.
Твердый оксид углерода (IV) называют «сухим льдом». При повышении температуры он превращается не в жидкость, а в газ (углекислый), т. е. не тает, а испаряется (высыхает). Сухой лед раньше использовали в торговле для охлаждения мороженого.
Обычный лед при температуре ниже 0 0 С также превращается в пар, правда, медленно. Благодаря этому сырое белье высыхает и на морозе.
Молекулярные вещества не проводят тепло и электрический ток (являются диэлектриками), это объясняется тем, что электроны, осуществляющие ковалентную связь между атомами в молекуле, по кристаллу не перемещаются.
Растворимость веществ с молекулярной кристаллической решеткой зависит от поляр- ности ковалентной связи. Вещества с ковалентной полярной связью хорошо растворяются в воде, вещества с неполярной связью в воде практически не растворяются. Вода поляр ный растворитель (в ее молекуле между атомами ковалентная полярная связь), поэтому в
воде хорошо растворяются вещества с ковалентными полярными и ионными связями. Молекулярное строение характерно для очень многих веществ. Однако большинство из них составляют органические вещества. Что касается неорганических веществ, то молеку-
лярное строение характерно только для некоторых из них.
Подавляющее большинство неорганических веществ составляют кристаллы, образованные сочетанием ионов или атомов, закономерно расположенных относительно друг друга.
Атомные кристаллические решетки – это решетки, в узлах которых расположены отдельные атомы, связанные между собой прочными ковалентными связями (полярными или неполярными). Так как атомы, подобно ионам, могут располагаться в пространстве по-разному, то в этих случаях образуются кристаллы различной формы. Например, в узлах кристаллических решеток алмаза и графита одни и те же атомы углерода, но из-за различного расположения атомов кристаллы алмаза имеют октаэдрическую форму, а кристаллы графита – призматическую. Атомная кристаллическая характерна не толькодля простых, но и для сложных веществ, например, для оксида кремния(IV) (кварца)Физические свойства веществ с атомной кристаллической решеткой. Ковалентные связи между соседними атомами очень прочны, поэтомувсе вещества с атомной кристаллической решеткой при нормальных условиях находятся в твердом агрегат
ном состоянии, не летучи (поэтому не имеют запаха) и имеют высокую механическую прочность. По этой же атомные вещества тугоплавки, например, кварц плавится только при температуре 1610 0 С.Пластичность у веществ с атомной кристаллической решеткой отсутствует. Если под действием деформирующей силы слои кристаллической решетки смещаются друг относительно друга, ковалентная связь (общая электронная пара) при этом разрушается.
При обычных условиях электроны по кристаллу практически не перемещаются, поэтому
электрическая проводимость веществ с атомной кристаллической решеткой ничтожна ма-
ла. Это диэлектрики.
В воде вещества с атомной кристаллической решеткой практически не растворяются.
Как видно, разное строение веществ приводит к существенным различиям в свойствах. До начала XX века в науке господствовало представление о том, что «все вещества состоят
из молекул». Исследования, проведенные в первые десятилетия прошлого века, убедительно доказали, что в кристаллах большинства неорганических веществ (ионных, атомных, металлических) молекул нет. Поэтому нельзя допускать таких выражений, как «молекула хлорида натрия», «молекула оксида меди» и т. д., если речь идет об этих веществах, находящихся в твердом состоянии. В газообразном состоянии эти вещества могут быть в виде как молекул, так и отдельных атомов, ионов и других частиц.
1. Межмолекулярное взаимодействие возникает между любыми молекулами, как полярными, так и неполярными. Молекулы притягиваются друг к другу довольно слабо. Связанные молекулы образуют молекулярные кристаллы (молекулярную кристаллическую решетку).
2. Вещества молекулярного строения имеют низкие температуры кипения и плавления, летучи, непластичны, диэлектрики.
3. Кристаллические структуры, построенные из атомов, связанных друг с другом ковалентными связями, называют атомными кристаллами, а кристаллическую решетку атомной.
4. Вещества с атомной кристаллической решеткой твердые, нелетучие, тугоплавкие, непластичные с высокой механической прочностью, диэлектрики, практически нерастворимы в воде.
Особенности строения атомов химических элементов-металлов. У атомов элементов-металлов на последнем энергетическом уровне небольшое количество электронов (один, два, реже три или четыре). Радиус атома металла больше, чем радиус атома неметалла, если элементы находятся в одном периоде и их атомы имеют одинаковое количество энергетических уровней. Поэтому валентные электроны металлов гораздо слабже притягиваются к ядру, чем валентные электроны атомов неметаллов.
Образование металлической химической связи. Валентных электронов у атома металла явно недостаточно, чтобы с другим атомом образовать прочную связь и достичь устойчивой восьмиэлектронной конфигурации (как в случае образования ковалентной связи).
Экспериментально доказано, что в парообразном состоянии некоторые металлы находятся в виде двухатомных молекул с ковалентной связью, например Li 2 . При образовании общей электронной пары, связывающей атомы лития
не достигается устойчивая структура внешнего слоя. Следовательно, молекулярное состояние для металлов не является энергетически выгодным. Очевидно, что для металлов характерен иной вид химической связи.
Итак, внешних и особенно неспаренных электронов у атомов металлов явно не достаточно, чтобы образовать устойчивую восьмиэлектронную конфигурацию атома. В этом случае для ее образования требуются электроны множества атомов металлов, которые «сбрасывают» свои неспаренные электроны в общее пользование. Эти электроны оказываются принадлежащими всем участвующим в этом процессе атомам. Между ними устанавливается связь, называемая металлической. Ее обеспечивают свободно перемещающиеся в объеме металла электроны, принадлежащие всем атомам, в виде «электронного газа».
Атомы металла, «сбросившие» валентные электроны, превращаются в положительно заряженные ионы – катионы, которые могут вновь притягивать к себе электроны из электронного газа и превращаться в нейтральные атомы:
Ме 0 – ne Me n+
Следовательно, система «атом – ион» очень подвижна.
Металлическая связь характерна для типичных металлов в твердом и жидком состояниях, для их сплавов и их интерметаллических соединений, образованных атомами разных металлических элементов.
Металлическая связь имеет некоторое сходство с ковалентной связь, поскольку основана на обобществлении валентных электронов. Однако при ковалентной связи обобществлены валентные неспаренные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы.
Металлическая кристаллическая решетка. В узлах металлической кристаллической решетки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои валентные электроны в общее пользование). А межатомное пространство заполняют «свободно» перемещающиеся электроны, осуществляющие химическую связь этих частиц.Наличие «свободных» электронов, или «электронного газа», в кристалле металла экспериментально доказано следующими опытами. При резком торможении быстро вращающегося куска металла появляется электрический ток. Он возникает также при резком ускорении движения куска металла.
Металлическую кристаллическую решетку имеют все металлы и все сплавы, даже если в состав сплава входит неметалл.
Физические свойства металлов. Металлы, кроме ртути, при обычных условиях – твердые вещества. Все металлы обладают металлическим блеском. Металлический блеск металлов объясняется способностью их кристаллов хорошо отражать свет (в мелко раздробленном состоянии металлы имеют обычно черный цвет и не блестят). Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала.
Отраженный поверхностью металлов свет определяет их цвет. Белый и серый цвета большинства металлов говорят о том, что металлы рассеивают в равной степени все лучи видимой части спектра. А вот золото и медь в большей степени поглощают лучи с короткой длиной волны (близкие к фиолетовым лучам) и отражают длинноволоновые лучи, поэтому окрашены соответственно в желтый и желто-красный цвета.
Температуры плавления металлов разнообразны. Самый легкоплавкий металл – ртуть (t пл = –38 0 С), самый тугоплавкий – вольфрам (t пл = 3390 0 С). Это свойство вольфрама используется для изготовления ламп накаливания. К тугоплавким относятся металлы с температурой плавления 1000 0 С.
По плотности металлы можно разделить на легкие (плотность менее 5 г/см 3) и тяжелые, плотность которых более 5 г/см 3 . Чем меньше относительная атомная масса, тем он легче. Так самый легкий металл литий (плотность 0,53 г/см 3), самый тяжелый – осмий (плотность 22,6 г/см 3).
Легкие металлы обычно легкоплавки, цезий и галлий могут плавиться уже на ладони руки, а тяжелые металлы – тугоплавкие.
Металлы различаются и по твердости. Самый твердым является хром; им можно резать стекло. Самые мягкие металлы – натрий, калий, свинец.
Все металлы ковки и пластичны.Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. При механической обработке металла слои кристаллической решетки сдвигаются друг относительно друга. Однако металлическая связь при этом не разрушается, поскольку ее обеспечивают общие электроны, выступая своеобразной смазкой между слоями.
Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий. А из одного грамма золота можно вытянуть проволоку в 3 км.
Хорошая электропроводность и теплопроводность металлов объясняется присутствием «свободных» электронов, которые в электрическом поле, направленно перемещаются от отрицательного полюса к положительному.
При охлаждении электропроводность металлов растет и вблизи абсолютного нуля перехо
дит в сверхпроводимость. Лучшими проводниками электричества являются серебро, медь и алюминий. Медь и алюминий используют для изготовления электропроводов.
Теплопроводность металлов объясняется высокой подвижностью свободных электронов. Если нагревать кусок металла с одной стороны, то при повышении температуры ионы и атомы в узлах кристаллической решетки начинают колебаться быстрее. Сталкиваясь с колеблющимися в узлах кристаллической решетки ионами и атомами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов и атомов при посредстве электронов передаются другим частицам, и температура металла быстро выравнивается.
Взаимосвязь между атомами, молекулами, ионами и кристаллами можно изобразить с помощью такой схемы:
Известно, что химия изучает вещества и их свойства. Для того чтобы объяснить почему то или иное вещество вступает или не вступает в химические процессы, нужно заглянуть внутрь его. Но атомы и молекулы, из которых состоят вещества, нельзя увидеть даже с помощью мощного микроскопа. Из материалов урока вы узнаете, как ученые-химики познавали и познают микромир, познакомитесь со следующими понятиями: "атом", "молекула", "вещества молекулярного и немолекулярного строения", "атомно-молекулярное учение".
I. Возникновение представлений об атомах и молекулах
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц - атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Древ-не-гре-че-ский фи-ло-соф Ари-сто-тель пред-по-ло-жил, что ос-но-ву всего со-став-ля-ют 4 сти-хии: огонь, вода, воз-дух и земля. Эти сти-хии на-хо-дят-ся во вза-и-мо-свя-зи и вза-и-мо-дей-ствии.
Ари-сто-тель счи-тал огонь, воду, воз-дух и землю неде-ли-мы-ми эле-мен-та-ми, ко-то-рые могут пре-вра-щать-ся друг в друга, а также со-еди-нять-ся друг с дру-гом, об-ра-зуя новые тела. Со-еди-не-ние эле-мен-тов с про-ти-во-по-лож-ны-ми свой-ства-ми счи-та-лось невоз-мож-ным: огонь не может со-еди-нить-ся с водой, а воз-дух с зем-лей.
Пред-по-ло-же-ние Ари-сто-те-ля было оче-вид-ным, по-это-му его пред-став-ле-ния вла-де-ли умами более ты-ся-чи лет. На-при-мер, мы знаем, что вода не горит. В со-от-вет-ствие с дан-ной мо-де-лью Ари-сто-тель счи-тал, что из од-но-го ве-ще-ства можно по-лу-чить любое дру-гое ве-ще-ство. Глав-ное - по-до-брать усло-вия его пре-вра-ще-ния.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 - 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов). Учение об атомах получило дальнейшее развитие в трудах известного английского ученого Джона Дальтона (1766 - 1844 гг.).
Это интересно
Как Демокрит представлял себе атомы?
Принято считать, что первым идею о том, что кажущаяся непрерывной материя на самом деле состоит из великого множества мельчайших и потому невидимых частиц, выдвинул древнегреческий философ Демокрит (V в. до н. э.). О жизни Демокрита нам, однако, практически ничего не известно, и оригинальные труды этого мыслителя до наших дней не дошли. Поэтому об идеях Демокрита остаётся судить в основном по цитатам из его работ, которые мы находим у других авторов, прежде всего у Аристотеля.
Логика рассуждений Демокрита была крайне проста. Представим, говорил он, что у нас есть самый острый в мире нож. Берём первый попавшийся под руку материальный объект и разрезаем его пополам, затем одну из получившихся половинок также разрезаем пополам, затем разрезаем пополам одну из получившихся четвертинок и так далее. Рано или поздно, утверждал он, мы получим частицу столь мелкую, что дальнейшему делению на две она не поддаётся. Это и будет неделимый атом материи. По представлениям Демокрита атомы были вечными, неизменными и неделимыми.
Идеи Демокрита не основывались ни на каких наблюдениях или практических опытах. Демокрит, подобно всем натурфилософам античности, просто рассуждал и делал умозрительные заключения относительно природы мира.
II. Молекулы и атомы
Фильм: “Молекула. Атом. Вещество”
Можно ли опытным путем доказать, что молекулы состоят из атомов?
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. Это кислород. В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. Это водород.
Объяснить это явление можно так. Мельчайшая частица воды - молекула состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы - атомы кислорода и водорода. Затем атомы соединяются по два, и из двух молекул воды образуется одна - двухатомная молекула кислорода и две водорода.
Некоторые представления об атомах и молекулах, высказанные М. В. Ломоносовым за полвека до Д. Дальтона, оказались более достоверными и научными. Например, английский ученый категорически отрицал возможность существования молекул, состоящих из одинаковых атомов. Его взгляды отрицательно сказались на развитие химии.Учение о молекулах и атомах окончательно было принято только в 1860 г. на Всемирном съезде химиков в Карлеруэ.
Молекулы - мельчайшие частицы вещества, состав которых и химические свойства такие же, как у данного вещества. Молекулы - предельный результат механического дробления вещества.
Атомы - это мельчайшие химически неделимые частицы, из которых состоят молекулы.
Молекулы, в отличие от атомов, являются химически делимыми частицами.
III. Вещества молекулярного строения
Молекулярные вещества молекулы
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода - жидкость, t пл =0°С; t кип =100°С
Вода - самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 / 4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода - молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название.
Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве - жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o - температура замерзания, 100 o - температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Примеры веществ молекулярного строения: водород, кислород, углекислый газ, этиловый спирт, ацетон, вода.
IV. Вещества немолекулярного строения
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Ион - это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na + , Cl - .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например: Поваренная соль - твердое вещество, t пл =801°С; t кип =1465°С.
Железо - серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом - никелем - оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) - один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.
Примеры веществ немолекулярного строения: алмаз, графит, металлы, соли
V. Строение вещества
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Наша задача познакомиться со строением вещества.
Если рассматривать общую совокупность планеты и космоса, то большая часть веществ и тел все же находится в состоянии газа и плазмы. Однако на самой Земле существенно и содержание твердых частиц. Вот о них мы и поговорим, выяснив, чем являются кристаллические и аморфные твердые тела.
Все твердые вещества, тела, предметы условно подразделяются на: кристаллические и аморфные. Разница между ними огромная, ведь в основе подразделения лежат признаки строения и проявляемых свойств. Если говорить кратко, то твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (анизотропия).
Если же характеризовать аморфные соединения, то первый их признак - способность менять физические характеристики по всем направлениям одновременно. Это называется изотропией. Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке - огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Свойства твердых тел
Кристаллические и аморфные тела тем не менее относятся к единой группе твердых, а значит, обладают всеми характеристиками данного агрегатного состояния. То есть общими свойствами для них будут следующие: Механические - упругость, твердость, способность к деформации. Тепловые - температуры кипения и плавления, коэффициент теплового расширения. Электрические и магнитные - проводимость тепловая и электрическая. Таким образом, рассматриваемые нами состояния обладают всеми данными характеристиками. Только проявляться у аморфных тел они будут несколько иначе, нежели у кристаллических. Важными свойствами для промышленных целей являются механические и электрические. Способность восстанавливаться после деформации или, напротив, крошиться и измельчаться - важная особенность. Также большую роль играет тот факт, может вещество проводить электрический ток либо не способно к этому.
Разница между аморфными и кристаллическими веществами огромная, ведь в основе подразделения лежат признаки строения и проявляемых свойств.
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует

VI. Жидкие кристаллы
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 200 0 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Это интересно
Одно и то же вещество может встречаться и в кристаллическом и в некристаллическом виде. В жидком расплаве вещества частицы движутся совершенно беспорядочно. Например, расплавить сахар: если расплав застывает медленно, спокойно, то частицы собираются в ровные ряды и образуются кристаллы. Так получается сахарный песок или кусковой сахар. Если остывание происходит очень быстро, то частицы не успевают построиться правильными рядами и расплав затвердевает некристаллическим. Так, если вылить расплавленный сахар в холодную воду или на очень холодное блюдце, образуется сахарный леденец, некристаллический сахар.
Вывод:
Аморфное тело ведёт себя как очень густая и вязкая жидкость. При низких температурах они ведут себя подобно кристаллическим телам, а при высокой подобны жидким.
VII. Типы кристаллических решёток
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку .
Кристаллическая решетка - это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p , t ,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) - аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода - графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно - серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.

Таблица: Свойства веществ с различной кристаллической решёткой
Если скорость роста кристаллов мала при охлаждении - образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.

Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
Атомная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся отдельные атомы.
Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами.
Число веществ с атомной кристаллической решеткой велико. Все они имеют высокую температуру плавления, не растворимы в жидкостях, обладают высокой прочностью, твердостью, имеют широкий диапазон электропроводимости (от изоляторов и полупроводников до электронных проводников). Атомная кристаллическая решетка характерна для элементов III и IV групп главных подгрупп (Si, Ge, B, C).

Ионная кристаллическая решётка образована ионами, связанными друг с другом электростатическим взаимодействием.
Такая кристаллическая решётка характерна, например, для поваренной соли — хлорида натрия.

Вещества с ионной кристаллической решеткой обладают высокой твердостью, хрупкостью, являются тугоплавкими и малолетучими. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и ослаблению прочности связи между ними. Поэтому расплавы, растворы таких кристаллов проводят электрический ток. Вещества с ионными кристаллическими решетками легко растворяются в полярных жидкостях, являются диэлектриками.
Молекулярная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся молекулы какого-либо вещества.

Вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления. Они малорастворимы в воде, не проводят электрический ток и обладают высокой летучестью. Примерами веществ с молекулярными решетками являются лед, твердый углекислый газ («сухой лед»), твердые галогенводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F 2 , Cl 2 , Br 2 , J 2 , H 2 , N 2 ,O 2 ), трех- (O 3 ), четырех- (P 4 ), восьми- (S 8 ) атомными молекулами. Большинство кристаллических органических соединений также имеют молекулярную решетку.
VIII. Закрепление
Задание №1. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (CH3 COOH), сахар (C12 H22 O11 ), калийное удобрение (KCl), речной песок (SiO2 ) - температура плавления 1710 0 C, аммиак (NH3 ), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
Задание №2. По формулам приведённых веществ: SiC, CS2 , NaBr, C2 H2 - определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
IX. Тренажеры
Тренажёр №1.
Тема 6. От атома к новым материалам, или кое-что о современной химии.
Следуя подходу о концептуальных системах в развитии химии можно выделить четыре этапа:
I. Учение о составе.
II.Структурная химия.
III. Учение охимическом процессе.
IV. Эволюционная химия.
Первая концептуальная система – «Учение о составе»: свойства вещества определяются его составом, то есть тем, из каких химических элементови в каком их соотношении образовано данноевещество.
Вторая концептуальная система – «Структурная химия»: свойства вещества определяются не только составом, но и порядком соединения атомов между собой и их расположением в пространстве, т.е. структурой объекта.
Третья концептуальная система – «Учение о химическом процессе»: свойства вещества определяются не только его составом и структурой, но и организацией системы, в которой это вещество находится. Иными словами, необходимо учитывать внешние условия и возможное участие в «жизни» системы веществ, напрямую «не участвующих» в химической реакции (катализаторы, растворители, примеси).
Четвертая концептуальная система – «Эволюционная химия»: свойства вещества определяются не только его составом, структурой, «технологией», но и процессами самоорганизации вещества. Такой подход только формируется и далек от завершения; он связан с включением в химическую науку необходимости изучения формирования веществ в неживой и живой природе в течение миллионов (а возможно, и миллиардов) лет, с построением теории химической эволюции материи.
В последние годы в мире много говорят о «зеленой» химии. Это связано с необходимостью в привлечении внимания как ученых-химиков, так и общественности к совершенствованию технологических процессов для защиты окружающей среды.
Ограниченность курса «Концепции современного естествознания» не позволяет остановиться подробно на всем многообразии химических подходов и задач, поэтому сосредоточимся лишь на одной из основных проблем – синтезе (получении) веществ с заданными свойствами. Для решения этого вопроса необходимо разобраться в том, какие основные факторы определяют свойства вещества. В этом нам поможет подход о концептуальных системах, упомянутый выше. В новом преломлении он выглядит следующим образом:
Для «полного счастья» необходимо знать и "способ приготовления" материала. Например - дамасская сталь, способ изготовления которой был утерян на долгие годы и воспроизведен лишь в конце XX века

В Дели, во дворе мечети Кувватуль-Ислам, уже сотни лет стоит и не ржавеет железная колонна (а мы привыкли, что «железо» автомобилей ржавеет очень быстро, за пару сезонов).

Сегодня ученые обращают внимание на необычные свойства материалов, полученных природой - например, очень крепкие нити паутины или очень надежные архитектурные коралловые постройки. Поэтому современная химия пытается раскрыть эти эволюционные тайны, чтобы создать прочные искусственные волокна. Оказалось, что одиночная нить, производимая пауком, по прочности не уступает стальной проволоке равного диаметра (но плотность стали в шесть раз больше, чем паутины). Канат, сплетенный из паутины, толщиной всего примерно с карандаш, мог бы удержать на месте бульдозер, танк или железнодорожный состав.
Начнем более подробное обсуждение вышеозвученных положений. В основе всех подходов – состав материалов, т.е. атомы и молекулы, из которых состоит все материальное в нашем мире.
Напомним, что атом - квантово-механическая система, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки
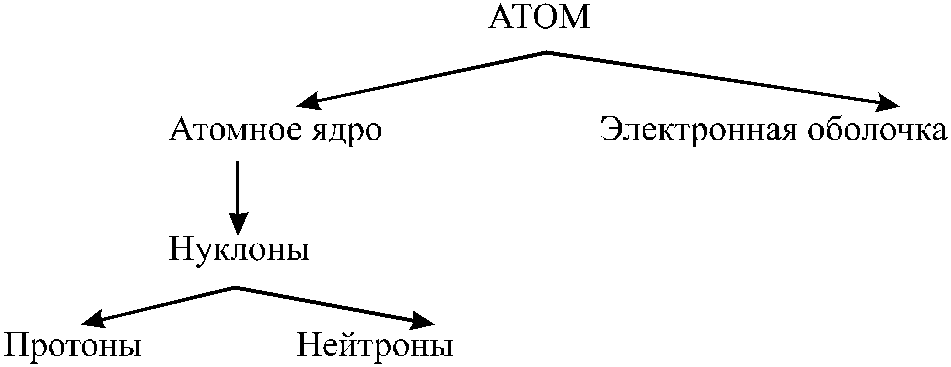
На сегодня атомы обозначаются следующим стандартным образом: , где S - символ атома, Z - атомный номер, равный числу протонов (т.е. заряду ядра), A=Z+N - массовое число, где N - число нейтронов. Таким образом, массовое число показывает полное число нуклонов. Ясно, что изотопы химических элементов имеют ядра с разным числом нейтронов, следовательно, различаются их массовые числа. В качестве примера приведем некоторые сведения об изотопах урана:
Изотопы урана
|
Изотопы урана |
Число протонов |
Число нейтронов |
Распространенность в земной коре, % |
Полураспада, годы |
Тип распада |
В природных условиях радиоактивность урана обусловлена изотопом 234 U.
Химические элементы, особенно их сочетания, во многом определяют свойства вещества, что отчетливо проявляется для многоатомных соединений. Например, рассмотрим ряд на основе водорода: H 2 , H 2 O, HCl, CH 4 ,. Первое соединение из двух атомов водорода - газ, второе – вода, получается при присоединении к двум атомам водорода одного атома кислорода, третье соединение - добавили водороду атом хлора и получили газ, при растворении в воде образующий соляную кислоту, четвертое - углеводород, состоящий из углерода и водорода и т.п. (естественно, все вещества находятся при нормальных условиях).
Многие (но далеко не все!) свойства химических элементов, а тем более соединений можно получить из анализа «таблицы Менделеева».
Не вдаваясь в детали, известные из школьных курсов химии и физики, вспомним строение нескольких первых атомов:
|
Химический элемент |
Число электронов на 1-й оболочке |
Число электронов на 2-й оболочке |
Число электронов на 3-й оболочке |
Свойства |
|
|
Активный газ |
|||||
|
2 (заполнена) |
Инертный газ |
||||
|
Активный металл |
|||||
|
Бериллий |
2 (заполнена) | ||||
(Задание: возьмите таблицу Менделеева и проанализируйте разбиение элементов по столбцам и линиям ).
Химические свойства атома (то есть то, какого рода связи будут образованы с другими атомами) определяются числом электронов в наружном слое. Так, у водорода и лития только по одному внешнему электрону, поэтому в химических реакциях они ведут себя похоже. В свою очередь, гелий и неон оба имеют заполненные внешние оболочки, и тоже ведут себя похоже, но совершенно не так, как водород и литий.
Окружающий нас мир состоит из 92 элементов (в 1930-е годы они все уже были открыты) - от водорода (атомный номер Z=1) до урана (Z=92), которые представлены 287 стабильными изотопами, т.е. химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе.Начиная с номера 93 идут искусственные элементы, созданные в лаборатории. К середине 1990-х годов было синтезировано уже 109 элементов (открыты тяжелые трансурановые элементы, которые живут очень короткое время). Время жизни радиоактивных изотопов уменьшается до тех пор, пока существует ядро атома: расчеты показывают, что может существовать около 5000 радиоактивных ядер.
Названия новым элементам даются в честь великих ученых или названий мест расположения научных центров: 101-й элемент – менделевий, 102-й - нобелий, 103-й - лоуренсий, 104-й - дубний, 105-й - жолиотий, 106-й - сиборгий, 107-й - борий, 108-й - хассий, 109-й – мейтнерий, 110-й – дармштатдий, 111-й - рентгений, 112-й – коперникий, 113 – 118 пока не названы.
Пока самый большой заявленный учеными номер - 118. У любознательного студента может возникнуть вопрос: а сколько всего может быть элементов? Элементы, стоящие в таблице за ураном, - искусственного происхождения. Чем выше их атомный номер, тем быстрее они распадаются. Но жизнь сверхтяжелых элементов стала, напротив, увеличиваться – появились "острова стабильности". С другой стороны, казалось бы, можно оценить электростатические силы притяжения внутренних электронов атомов к положительно заряженному ядру. Для тяжелых элементов, имеющих большой заряд ядра, электронная «шуба» сильнее сжимается, сильнее притягиваются внутренние электроны к ядру и электроны начнут захватываться ядром. Но законы квантовой механики показывают, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.
Перейдем от разрозненных химических элементов к химическим соединениям, чтобы понять, чем определяются свойства материалов. Напомним, что химическое соединение - это вещество, состоящее из атомов одного или нескольких сортов, которые объединены в частицы - молекулы, комплексы, кристаллы или иные агрегаты. Различают соединения постоянного состава (дальтониды) и переменного (бертоллиды).
Молекула - наименьшая частица вещества, которая полностью определяет его свойства и в то же время существует самостоятельно.
Причина образования химических соединений заключается в различной физической природе химических сил, объединяющих атомы в молекулу как единую квантово-химическую систему. Химическая связь обусловлена обменным взаимодействием электронов (обобщение валентных электронов). Теперь химическое соединение можно трактовать как вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет обменного взаимодействия (химической связи) объединены в частицы - молекулы, комплексы, монокристаллы или иные агрегаты. Укажем, что химическое соединение может состоять и из атомов одного элемента например, кислород, алмаз и т.л.
Различают четыре вида химической связи - ионную, ковалентную, металлическую и водородную.
1. Ионная связь
Ионная связь: один из атомов легко отдает электрон с внешней оболочки, а атом другого сорта легко принимает к себе этот электрон. Образовавшиеся ионы (катион - положительно заряженная частица и анион - отрицательно заряженная) за счет сил электростатического взаимодействия притягивают друг друга. Например, в кристалле NaCl катионы Na + притягивают анионы Cl - .
|
|
|
Пример ионной связи |
2. Ковалентная связь
Ковалентная связь: ни один из атомов не может полностью отдать электрон. В этом случае происходит частичное “объединение” электронов, т.е. электрон проводит часть времени у “своего” старого ядра, а часть времени - у нового.
3. Металлическая связь
Металлическая связь: в этом случае происходит полное обобществление электронов, ядра как бы находятся в “электронном газе” (или “жидкости”). При этом электроны могут легко двигаться, что и объясняет малое электрическое сопротивление металлов.
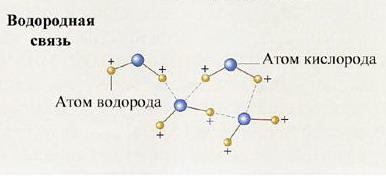
4. Водородная связь
Водородная связь: проявляется как результат взаимодействия атома водорода с электроотрицательным атомом и неподеленной парой электронов другого атома. Водородная связь приводит к ассоциации одинаковых или различных молекул в различные комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др.
|
|
|
Пример водородной связи |
В природе перечисленные типы связей в «чистом виде» проявляются редко, в большинстве соединений имеет место наложение разных типов связей.
Атомное строение тел. Различные состояния вещества.
Кроме того, что свойства соединения зависят от его состава, очевидно, что большое значение имеет атомное строение тел, т.е. расположение атомов в пространстве. Действительно, напомним самый простой пример: хотя вода и лед имеют один и тот же химический состав, свойства их существенно различны.
Очевидно, что с понятием структуры связаны и агрегатные состояния вещества. Большинство веществ может существовать в трёх агрегатных состояниях - твёрдом, жидком и газообразном. Например – вода, которая при обычном давлении (p= 760 мм рт.ст.) может находиться в виде льда (при t < 0 О С), жидкости (от нуля до 100 О С) и водяного пара (приt>100 O C).
Четвёртым агрегатным состоянием вещества считают плазму.
Переход из одного агрегатного состояния вещества в другое сопровождается скачкообразным изменением расстояний между молекулами (атомами) (и, как следствие) межмолекулярных взаимодействий. Как известно, в любом веществе его частицы (молекулы, атомы) находятся в непрерывном движении, и степень (интенсивность) этого движения характеризует температура. С другой стороны, эти частицы взаимодействуют между собой благодаря наличию химических связей. При низких температурах энергия связей частиц больше энергии тепловых колебаний частицы, частицы не могут «удалиться» друг от друга на большие (конечно, по сравнению с размерами атомов, т.е. 10 -8 см) расстояния - вещество существует в твердом состоянии. Зачастую частицы образуют правильную геометрическую структуру, в таком случае, говорят о кристаллической структуре. У твёрдых тел в кристаллообразном состоянии атомы совершают только колебания около равновесных положений, или узлов кристаллической решётки; структура этих тел характеризуется высокой степенью упорядоченности - дальним и ближним порядком. Если дальний порядок отсутствует, то имеем аморфное состояние (например, стекло).
|
|
|
Агрегатные состояния вещества |
При повышении температуры энергия тепловых колебаний частиц возрастает, энергия тепловых колебаний увеличивается и энергии связей уже недостаточно, чтобы удерживать частицы. Связи между частицами постоянно разрушаются и вновь образуются, частицы начинают двигаться не только около положений равновесия, но и перемещаться на достаточно большие расстояния. Однако они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается - вещество существует в жидком состоянии. Иными словами, молекулы (атомы) колеблются около положений равновесия и совершают перескоки из одного положения равновесия в другое. При этом в жидкостях наблюдается порядок только в расположении ближайших частиц (ближний порядок, в отличие от дальнего порядка в кристаллах), а также свойственные им подвижность и текучесть.
При дальнейшем повышении температуры тепловые колебания увеличиваются, в результате молекулы практически не взаимодействуют друг с другом и движутся фактически свободно, заполняя весь объём. Вещество переходит в газообразное состояние. В “идеальном” газе частицы свободно перемещаются во всех направлениях.
Если еще сильнее повысить температуру (до тысяч или даже десятков тысяч градусов, то удастся «разрушить» атомы и перевести вещество в четвертое состояние - плазму, которая представляет собой газ, состоящий из смеси нейтральных и ионизованных молекул и электронов. Таким образом, при переходах твердое тело жидкостьгазплазма происходит «уничтожение» порядка на различных уровнях.
Указанные четыре основные состояния вещества - плазменное, газообразное, жидкое и твердое (перечисленные в порядке существования при понижении температуры), известны давно, однако на сегодня ученые выделяют еще два состояния – низкотемпературные конденсаты. Конденсат - новое состояние вещества при сверхнизких температурах - меньше 0.00000001 К (!!!), т.е. при температурах ниже температуры космического вакуума (в космосе температура около 3 К).
Покажем на конкретном примере твердого тела влияние атомной структуры на свойства материала. Для этого выберем простой одноатомный материал - углерод.
В твердом состоянии углерод может быть кристаллическим и аморфным и каждое его состояние имеет свое название.
1. Сажа - аморфный углерод в виде порошка тонкого помола (к настоящему времени установлено, что по своей структуре в саже, коксе, стеклообразном углероде и им подобных материалах углерод в разной степени приближается к графиту. Говоря о свойствах сажи, можно отметить, что электропроводность сажи равна нулю, т.е. сажа - электрический изолятор.
|
|
|
Структура аморфного графита |
2. До начала 60-х годов считалось, что в природе существуют только две кристаллические формы чистого углерода, а именно трех- и двумерные полимеры, т.е. алмаз и графит. Структура графита характеризуется слоями; атомы в слоях сильно связаны друг с другом, в то время как межслоевые взаимодействия незначительны. Поэтому графит легко расщепляется по слоям, он - мягкий кристаллический материал. В отличие от сажи, графит - очень хороший проводник электричества.
3. Алмаз обладает кубической кристаллической структурой, построенной все из тех же самых атомов углерода. В отличие от графита, алмаз - твердый кристаллический материал (возможно, самый твердый). Такие свойства связаны с его структурой, поскольку все атомы равноудалены друг от друга и крепко “связаны” друг с другом.
4. В 1985 г. было открыто большое семейство сферообразных углеродных молекул – фуллеренов. Фуллерены - новый вид углерода. Это замкнутые молекулы типа С 60 , С 70 , С 74 ..., в которых все атомы углерода находятся на “сферической” поверхности. В структуре фуллерена С 60 (диаметр молекулы составляет около 1 нм) атомы углерода расположены в вершинах правильных шестиугольников или пятиугольников (в конденсированном (кристаллическом) состоянии фуллерены называются фуллеритами). Фулллерены были найдены в некоторых природных минералах, например, в карельском шунгите. На основе фуллерена были синтезированы новые классы веществ: например, при взаимодействии с металлами получены фуллериды.
Интересные свойства этих материалов связаны с “захватом внутрь” шара различных атомов - Na, K. Полученные фуллериды обладают сверхпроводимостью (при температурах 19-55 K), а при использовании металлов платиновой группы дополнительно проявляются ферромагнитные свойства. Интересным свойством фуллеренов при низких температурах и давлении является способность поглощать водород. В связи с этим возможно использовать фуллерены в качестве основы для производства аккумуляторных батарей. В капсуле фуллерена могут помещаться лекарственные препараты, которые будут избирательно доставляться к поврежденному органу или ткани.
5. Графитовые нанотрубки - новый вид углерода, получены в 1991 г. Углеродная нанотрубка может быть представлена как свернутая в виде цилиндра графитовая плоскость. Трубки могут быть одностенными и многостенными, если получены из нескольких графитовых слоев. Диаметр трубки колеблется от одного до нескольких десятков нанометров, а длина может доходить до нескольких сантиметров; обычно трубки заканчиваются полусферической головкой. Углеродные нанотрубки обладают уникальными механическими (очень прочные), электрическими и термическими свойствами (электропроводность и теплопроводность приближались или превышали показатели металлов).
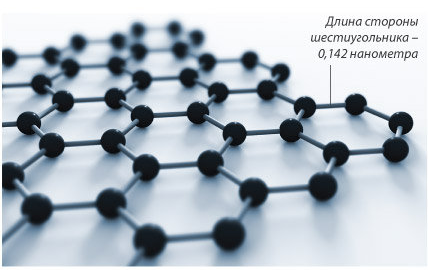
6. Нобелевская премия в области физики 2010 года присуждена выходцам из России, работающим в Великобритании, Андре Гейму и Константину Новосёлову "за новаторские эксперименты по исследованию двумерного материала графена". В 2004 году они экспериментально доказали возможность получения особой формы углерода, представляющей собой лист толщиной в один атом, соединенных в двумерную кристаллическую решетку из правильных шестиугольников. Иными словами, графен - это один отдельный слой хорошо известного графита. Графен самый тонкий и самый прочный из известных материалов, с другой стороны он очень гибок, способен проявлять свойств как проводника (вспомним графит), так и полупроводника.
|
|
|
Структура графена |
Вышеперечисленные примеры неорганических материалов дают веские доказательства того, что свойства соединений в значительной мере определяются атомной структурой материала. Еще больший успех в этом направлении выпал на долю органической химии, когда в результате органического синтеза было получено много новых материалов.
Новые подходы к синтезу новых неорганических материалов
В последние годы наблюдается интенсивное развитие различных областей науки и техники, связанных с применением неорганических материалов – это и машиностроение, и космическая и военная индустрия, и атомная отрасль. Постановка этих вопросов заставляет искать нетривиальные способы решения, например, выращивать некоторые кристаллы в космосе или использовать взрывные технологии.
Что же могут предложить ученые, чтобы расширить диапазон применяемых методик при создании (синтезе) новых материалов, учитывая роль химических процессов? Казалось бы, с уменьшением температуры должно уменьшатся число активных молекул и, следовательно, скорость реакции. Но неожиданно оказалось, что возможен синтез материалов при низких температурах жидкого азота – мы говорим о криохимии. В этом случае протекание реакций при низких температурах связано с изменением механизма процесса, поскольку образуются легко разлагающиеся (термически нестойкие) молекулярные комплексы, которые и участвуют в данном химическом процессе. Кроме того, понижение температуры по-разному влияет на механизм сопутствующих друг другу взаимодействий, что позволяет реализовать высокоселективный химический процесс (побочные химические процессы при низких температурах подавляются).
Идея криохимической технологии твердофазных материалов, зародившаяся свыше тридцати лет назад в Московском государственном университете и впервые реализованная академиком Ю.Д. Третьяковым, позволяет получать на основе криопорошков высококачественную керамику.
Другой пример нового направления в синтезе материалов лежит далеко от низких температур – в области высоких температур, при которых осуществляются реакции горения одного металла в другом или металла в азоте, углероде, кремнии. Это так называемый самораспространяющийся высокотемпературный синтез (СВС) тугоплавких материалов, открытый в 1967 году академиком Мержановым А.Г.
|
|
|
Основные этапы процесса СВС |
В смеси порошков в одном месте осуществляется локальный разогрев («поджиг») и начинается реакция синтеза. Выделившееся в результате экзотеpмической реакции тепло нагревает соседние (более холодные) слои вещества, в которых возбуждается реакция и возникает самоподдерживающийся процесс. В таком процессе химическая реакция, сопровождающаяся ярким свечением, протекает в узкой зоне, которая самопроизвольно распространяется по материалу. Такой процесс является разновидностью горения и рассматривается на основе теории горения.
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter